合作客戶/
拜耳公司 |
同濟大學 |
聯合大學 |
美國保潔 |
美國強生 |
瑞士羅氏 |
相關新聞Info
兩種抗菌肽與生物膜之間的相互作用的比較——結果和討論、結論
來源:上海謂載 瀏覽 1130 次 發布時間:2022-01-12
結果
抗菌肽在脂質單層中的滲透
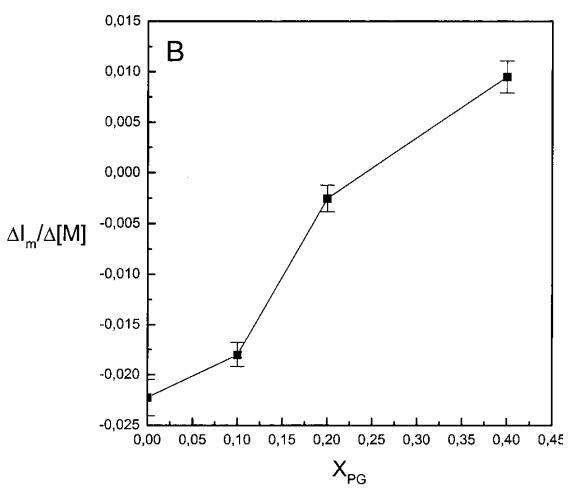
通過測量表面壓力的增量,觀察到抗菌肽在不同初始表面壓力(π0)下嵌入到空氣/水界面上的脂質單層中(?π)將肽添加到亞相后(Brockman,1999;Verger和Pattus,1976)。Magainin 2在π0>12 mN/m時容易插入SOPC單層(圖1A),而在π0以上≈35 mN/m時,其在膜中的滲透被消除,因此該值表示該肽與SOPC膜相互作用的臨界包裝壓力πc。根據其凈正電荷4(Matsuzaki,1998),當膜中酸性磷脂POPG的含量增加時,magainin 2向脂質單層的滲透逐漸增強(圖1 A)。因此,消除magainin 2插入單層的πc值增加至~39(XPG=0.1)、43(XPG=0.2)和46 mN/m(XPG=0.4)(圖1c)。相反,在SOPC膜中加入膽固醇(Xchol=0.1)對magainin 2的滲透沒有顯著影響(圖1A)。
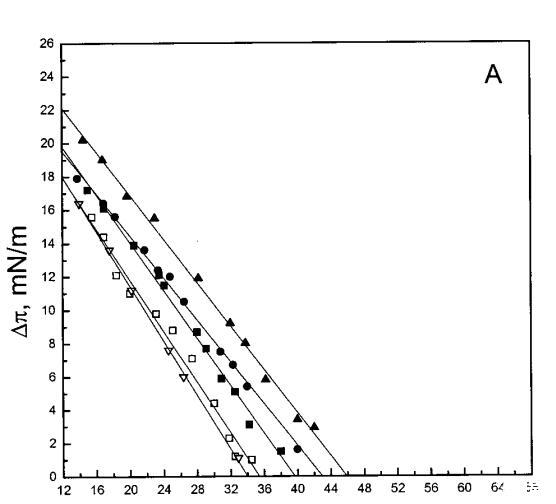
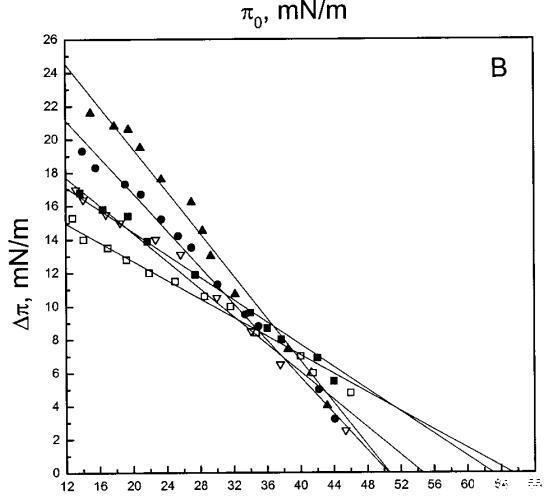
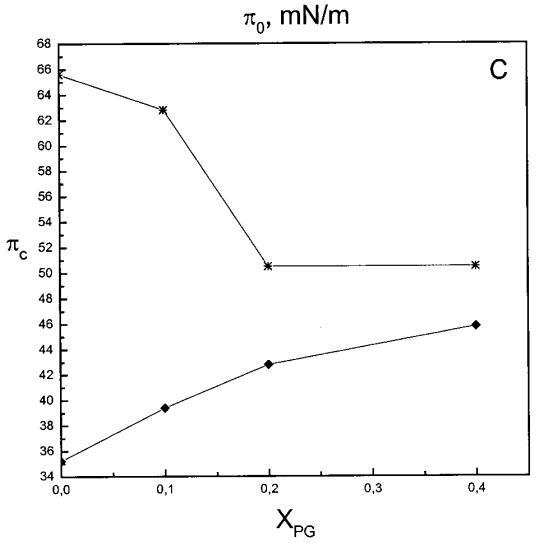

吲哚西丁的π也顯著增加,顯示其插入SOPC單層(圖1b)。然而,吲哚青素的膜活性明顯高于magainin 2,具有πc≈65mN/m,用于SOPC膠片。與magainin 2類似,單層中POPG含量的增加增強了吲哚青霉素的滲透,增加了?π低于~38 mN/m,與肽和脂質單層之間的靜電相互作用一致。然而,在后一個表面壓力值之上,吲哚西丁引起的π增量被POPG減弱。因此,與magainin 2相反,在存在POPG的情況下,πc減小(圖1c),在XPG=0.4時從~65 mN/m(對于SOPC單層)變為~50 mN/m。在SOPC單層中,吲哚西丁增加的π也被膽固醇(X=0.1)增加,而πc降低至~54 mN/m。圖1所示的magainin 2和吲哚西丁的模式非常不同,后一種肽的明顯交叉點為~38 mN/m。
抗菌肽對雙層脂質動力學的影響
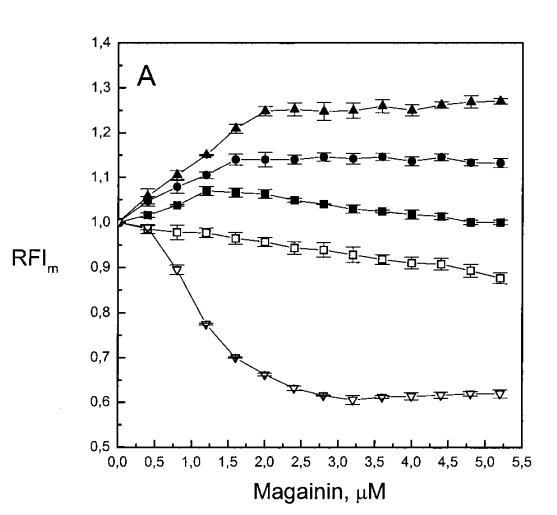
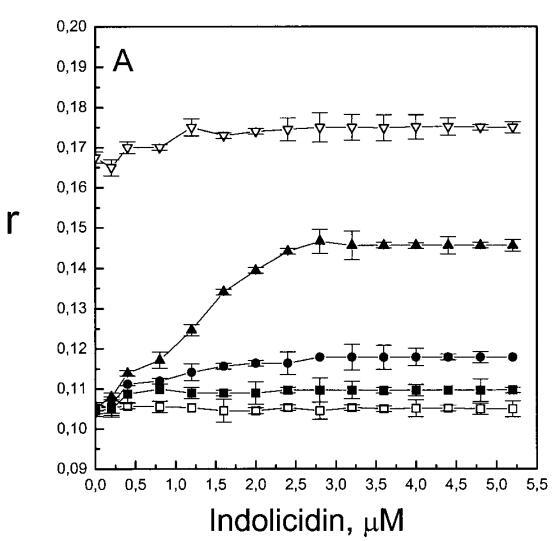
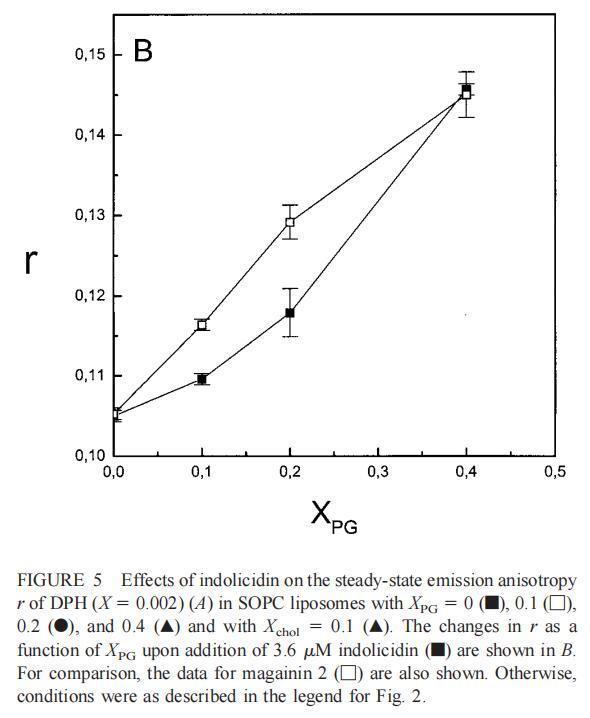
繼上述單層研究之后,有興趣探索肽對脂質動力學的影響。這是通過使用熒光光譜和不同脂質成分的LUV完成的,記錄芘標記的熒光磷脂類似物PPDPC或PPDPG的發射光譜(均為X=0.01)。對于SOPC LUV,添加magainin 2導致芘熒光顯著猝滅,芘單體和準分子發射強度平行降低,如Im所示(圖2)。作為XPG的一項功能,還研究了馬蓋寧2與脂質體結合的后果。當XPG從0.1增加到0.4時,觀察到由于magainin 2在398 nm處逐漸增強的Im(RFIm),而Im的初始增量在明確定義的PG/magainin 2化學計量比~2、3和5時趨于平穩(圖2 A)。在這個初始階段之后,直到給定的化學計量比,還有第二個過程,其斜率也隨著XPG的增加而增加(圖2b)。在XPG=0和0.1時,Magainin 2僅引起Ie/Im的輕微變化,而在XPG=0.2和0.4時,分別減少10%和25%是明顯的(圖3 A)。為了區分脂質動力學中兩種性質不同的變化,即側向遷移率和微結構域形成,作為上述Ie/Im變化的根本原因,我們還通過測量DPH的熒光各向異性r來評估酰基鏈順序的變化(圖3 B)。在缺乏酸性磷脂的情況下,Magainin 2幾乎不會引起r的變化(圖3B)。然而,隨著XPG的增加,加入magainin 2后脂質堆積和酰基鏈順序逐漸增加(圖3b),XPG=0.4時,r最大增加1.4倍。值得注意的是,XPG=0.1時Ie/Im沒有變化以及酰基鏈順序的增加表明PPDPG正在發生微觀富集。有趣的是,在存在膽固醇(Xchol=0.1)的情況下,由于馬蓋寧2的作用,Im和Ie都顯著降低,Ie/Im的變化不顯著(圖2A和3A)。如前所述(van Ginkel et al.,1989),添加肽前r的增加(圖3 B)揭示了通過在膜中摻入膽固醇而增強的膜順序。然而,在膽固醇存在的情況下,magainin 2對r沒有進一步的影響(Xchol=0.1,圖3b)。

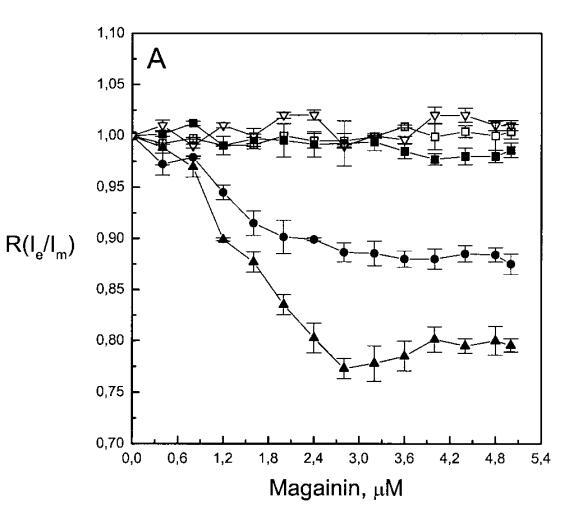
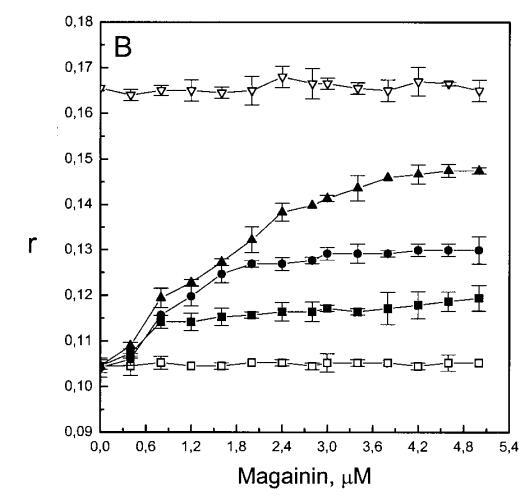

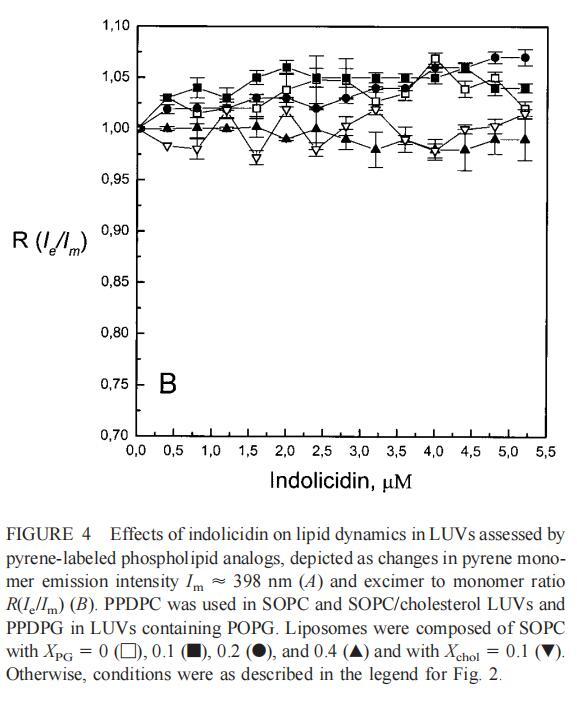
隨后,我們進行了與上述相同的測量,但使用吲哚西丁。與magainin 2類似,吲哚西丁也導致SOPC LUV的Im和Ie同時減少,如圖4a所示。然而,與magainin 2相反,當存在酸性磷脂POPG時,芘熒光的猝滅也很明顯。當肽/脂摩爾比為1/20時,Im按XPG?0.40.20.10順序下降。當XPG=0.4且肽/脂摩爾比>1:12.5時,Im值進一步降低。吲哚西丁引起的Im最大減量為15%(XPG=0)至40%(XPG=0.4)。盡管Im降低,但Ie/Im未顯示因吲哚西丁引起的顯著變化(圖4b)。有趣的是,在Xchol=0.1時測量到Im的最大下降(圖4a)。與magainin 2類似,當吲哚西丁添加到SOPC LUV中時,DPH各向異性r保持不變(圖5a)。然而,在含有酸性磷脂的膜中,吲哚西丁導致脂質堆積增加和酰基鏈順序增加,明顯表現為r增加(圖5a)。此外,r的增加取決于XPG,隨著雙層中酸性磷脂含量的增加而增加(圖5b)。相應的最大增幅為1.05倍至1.39倍。在膽固醇存在的情況下,也觀察到吲哚肽引起的膜酰基鏈順序的增加,使r增加1.06倍(圖5a)。
抗菌肽對膜拓撲結構的影響
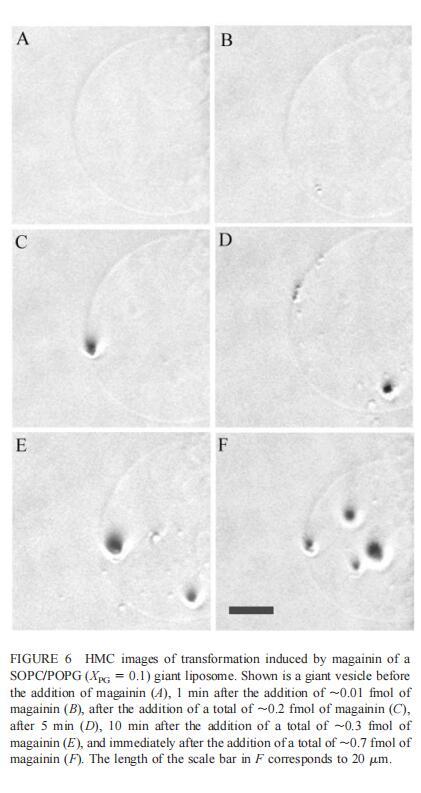
由于上述magainin 2和吲哚西啶對單層和LUV具有明顯的脂質成分依賴性作用,因此有興趣使用巨型脂質體比較這些肽對宏觀膜的三維拓撲結構的影響,無論是否含有PG,都可以在交流電場中形成由SOPC組成的巨大脂質體。即使暴露于大量肽(~2 fmol,~4 pl=200次重復注射,數據未顯示),SOPC膜也不受magainin 2的影響。同樣,由SOPC和膽固醇(Xchol=0.1)組成的巨大脂質體也不受此量的馬蓋寧2的影響(數據未顯示)。然而,在存在POPG(XPG=0.1)的情況下,已經~0.01 fmol(單次~20 fl注射)的magainin 2應用于巨大囊泡表面,顯著影響巨大脂質體膜的拓撲結構(圖6 B)。更具體地說,在~1分鐘內,小顆粒(θ≈0.9米)出現在巨大的囊泡內。隨后注射高達~0.1 fmol(約200 fl)的magainin 2不會引起進一步的可見變化。在總共添加約0.2 fmol的肽后,膜開始起伏,形成致密顆粒(θ≈4 m)在巨大脂質體內可見(圖6 C)。在~5分鐘內,幾個小顆粒(θ≈0.9 m)出現在巨大脂質體膜的內表面(圖6 D)。隨后,大多數小顆粒進入巨大囊泡的內腔。這些內吞小泡似乎在巨大脂質體內自由移動,在隨后30分鐘的觀察中沒有進一步的變化。進一步注射magainin 2,提供總共0.3 fmol的肽,引起類似內吞作用的過程,出現直徑約8 m的致密顆粒(圖6 E)。約10分鐘后,巨大脂質體內約0.9-m顆粒的數量繼續增加。偶爾,這些顆粒也出現在巨大囊泡的外表面,并釋放到外部緩沖液中(圖6 E)。隨后添加magainin 2(~0.7 fmol)使膜不穩定并誘導進一步的囊泡形成(圖6 F)。這些內吞囊泡在巨大脂質體內彼此分離,巨大囊泡的大小明顯減小(圖6f)。最終,在進一步添加magainin 2(高達~1.5 fmol)后,巨大的脂質體膜崩塌。上述形態學變化具有高度的可重復性。
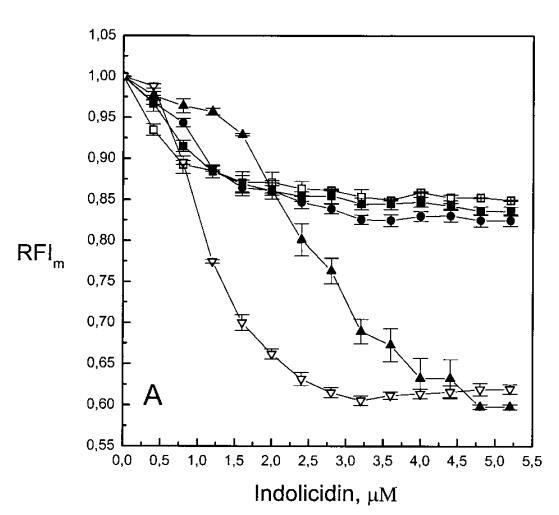
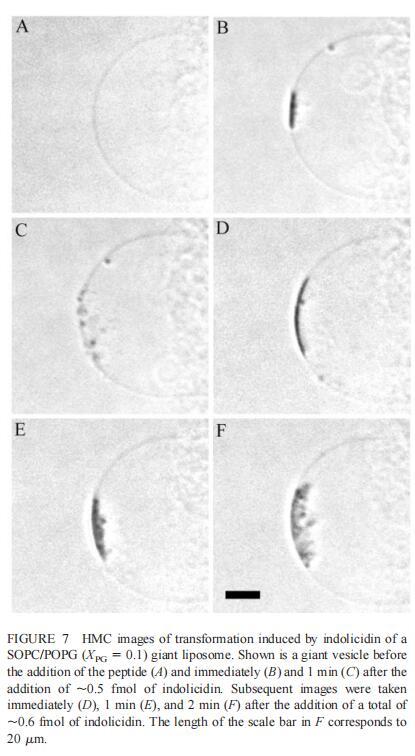
隨后,我們研究了吲哚西丁對由SOPC及其與POPG(XPG=0.1)的混合物組成的巨大脂質體的影響。對于SOPC巨型脂質體,唯一明顯的變化是在其表面應用~2 fmol(~200次注射)吲哚西丁后出現輕微收縮(數據未顯示)。然而,當囊泡含有POPG(X=0.1)時,吲哚西丁(~0.5 fmol)誘導類似內吞作用的過程(圖7),巨大脂質體內出現小顆粒(~0.9 m)。添加約0.5 fmol吲哚西丁(50次注射)后,暴露于吲哚西丁的巨大脂質體表面區域變暗,折射率發生顯著變化,表明形成緊密堆積的三維結構,僅部分保留在焦平面內(圖7b)。小粒子(θ)≈在上述聚集體形成后約1分鐘內,巨大脂質體內出現0.9 m(圖7 C)。隨后再添加0.1 fmol吲哚西啶后,膜表面的聚集物仍然存在,更多的小直徑顆粒出現在巨大的囊泡內(圖7,DF)。這種類似內吞作用的過程在隨后添加吲哚西丁的情況下重復,大量小顆粒逐漸積聚在巨大脂質體內,并且巨大脂質體的大小略有減小。
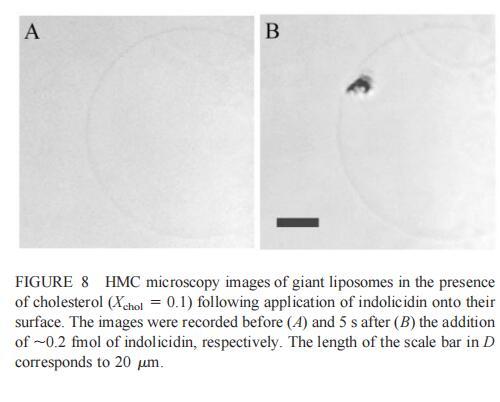
隨后,我們研究了吲哚西丁對由SOPC和膽固醇組成的巨大脂質體(Xchol?0.1)的影響。吲哚西丁在膽固醇存在的情況下也會引起巨大脂質體的起泡。形成的內吞小泡在巨大小泡的表面上深度聚集(圖8b)。具體地說,在添加約0.2 fmol吲哚西啶(~400 fl,20次注射,圖8 B)后約5 s內,巨大脂質體表面出現一簇小顆粒。隨后,聚集物轉移到巨大的脂質體中,同時也有少量內吞顆粒(θ≈0.9米)處可見。進一步添加吲哚西丁會增加這些顆粒的數量,并導致巨大脂質體收縮。然而,即使在暴露于~2 fmol吲哚西丁(200次注射,數據未顯示)的情況下,膜大體上仍保持完整。
討論
馬蓋寧2和吲哚青霉素的膜活性
單層實驗顯示,magainin 2和吲哚西啶具有高度的膜活性(圖1),在空氣/水界面上的脂質膜下注射后,表面壓力顯著增加。根據膜的組成,發現了與表面壓力πc對應的臨界堆積密度,超過該密度,這些肽不再與單層相互作用,從而導致π的增加(Verger和Pattus,1976)。盡管這兩種肽插入兩性離子磷脂酰膽堿單分子膜,但它們優先與酸性磷脂相互作用,與其凈陽離子電荷保持一致(Matsuzaki等人,1991、1993、1995a、1998;Ladokhin等人,1997)。然而,PG對其穿透力的影響明顯不同,吲哚西丁在~38 mN/m的表面壓力下有一個交叉點,吲哚西丁的斜率為?存在PG時,π與π0的比值變得更陡(圖1)。相比之下,斜坡??與π0相比,magainin 2的穿透力未因PG的存在而改變(圖1A)。我們的數據表明,magainin 2更表面地附著于單層,其穿透深度增加PG,并隨著表面壓力的增加而逐漸減小,其長軸相對于層平面的角度在不同壓力下保持相對不變。上述magainin 2與脂質單分子膜的相互作用模式可兼容1)其主要為=-螺旋構象,PG增加=-螺旋度(Wieprecht et al.,1997),和2)該肽在其長軸平行于層平面的情況下向脂質雙層的淺層滲透(Bechinger等人,1993年;Matsuzaki等人,1994年)。在π>πc時,magainin 2仍可能與單層中的PG靜電結合,盡管沒有穿透膜,因此不會導致π增加。最后,我們的數據還表明,與雙層不同,magainin 2不會在脂質單層中采用垂直方向(即其=-螺旋的長軸垂直于層平面)。
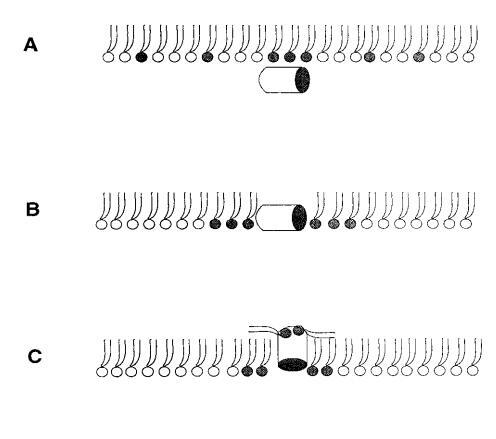
對于測試的所有單層組成,吲哚青霉素的πc值超過了馬蓋寧2的測量值(圖1 c),表明該肽在酰基鏈之間有效插入和插層。吲哚西丁在~38 mN/m的交叉點值得關注。在后一個表面壓力之下,表面壓力的增量??在PG存在的情況下,吲哚西丁引起的反應增強,而在較高的初始脂質堆積密度下觀察到相反的反應。有趣的是,不管脂質成分(即PG的存在)如何,交叉點幾乎保持不變,因此表明它可以完全由表面壓力決定,而不管靜電相互作用如何。一種可能的機制是,在π0>38 mN/m時,吲哚西丁以壓力依賴的方式改變其在單層中的取向,可能是從其長軸相對于層平面的平行到垂直取向(圖9,B和C),從而減少面積/肽并減少?π.此外,一些靜電結合吲哚肽的PG分子也可能與單層中的磷脂方向不同。換句話說,吲哚西丁與其相關的PG將形成一種超分子復合物,其取向將取決于壓力。這在圖9中示意性地示出。重要的是,所提出的肽連接磷脂的重新定向將與最近提出的模型兼容,在該模型中,穿過雙層的孔表面的一部分將由脂質頭基構成(Ludtke et al.,1996)。
magainin 2和吲哚西啶對雙層脂質動力學的影響
雖然熒光光譜顯示,馬蓋寧2和吲哚西啶對脂質動力學的影響存在明顯差異,但也存在一些明顯的相似之處。因此,DPH各向異性r的增加表明,在存在酸性磷脂的情況下,這兩種肽都會導致酰基鏈順序的增加,這種影響的程度隨著XPG的增加而增加(圖3b和5b)。同樣,在膽固醇存在的情況下,兩種肽對芘熒光的有效猝滅也很明顯(圖2a和4a)。這可能與膽固醇的OH基團和馬蓋寧的E19殘基之間的相互作用有關(Tytler等人,1995年),該肽在膜中具有跨膜取向。當Xchol=0.1時,r值的增加是由于吲哚西丁所致,而馬加寧則無影響。這表明,在膽固醇存在的情況下,吲哚肽可能采用跨雙層取向,其長軸垂直于雙層平面。
這兩種抗菌肽對芘標記的磷脂類似物的猝滅機制令人感興趣。可能涉及π-陽離子相互作用(Dougherty,1996),后者由肽的堿性殘基表示。吲哚西丁具有較高的Trp含量(39%),可促進其分配到脂質雙層(Wimley和White,1996)。因此,芘和色氨酸之間的π-相互作用也是可能的。已經證明,色氨酸可以淬滅膠束溶液中各種芘衍生物的熒光發射(Encinas和Lissi,1986;Altamirano等人,1998)。另一種可能性是鏈反轉(Holopainen et al.,1999),通過肽與脂質雙層結合,導致芘部分調節到更極性的環境中,從而增加熒光團微環境的極性,并導致量子產率降低。
除上述相似性外,當使用芘標記的脂質類似物研究酸性磷脂對脂質動力學的影響時,兩種肽之間也存在明顯差異。Magainin 2導致兩性磷脂組成的LUV的芘發射顯著猝滅(圖2A)。然而,在PG存在的情況下,芘的單體強度增加,XPG逐漸增加了這種效應的幅度(圖2A)。圓二色性、拉曼光譜、傅里葉變換紅外光譜和固態核磁共振研究表明,馬蓋寧在與脂質雙層結合時采用螺旋構象(Matsuzaki等人,1989年、1991年;Williams等人,1990年;Jackson等人,1992年;Bechinger等人,1993年;Wieprecht等人,1997年;Hirsh等人,1996年)。magainin 2對兩種膜的這些不同影響可能是由于1)通過與肽的帶正電基團(例如賴氨酸的?氨基)直接接觸使芘熒光猝滅,或2)插入雙層的=-螺旋肽改變熒光團的微環境,與層平面平行,如上所述。然而,在PG存在的情況下,肽的正電荷應在與酸性磷脂形成靜電復合物時被中和,從而減少由于π-陽離子相互作用導致的芘熒光猝滅。
有趣的是,在存在酸性磷脂的情況下,肌動蛋白/脂質的摩爾比(在該摩爾比下,肌動蛋白的初始增量趨于穩定)分別為1:21、1:16和1:12.5,對應于XPG=0.1、0.2和0.4(圖2A),分別產生1:2、1:3和1:5的肌動蛋白/磷脂化學計量比。同時,DPH的初始r增量在magainin/脂質摩爾比為~1:30、1:12和1:5時趨于平穩(XPG分別為0.1、0.2和0.4),對應于大約1:3、1:2.5和1:2的magainin/PG化學計量比(圖3)。據報道,在這些肽/脂質摩爾比下,magainin可插入含酸性磷脂的膜中(Ludtke等人,1994年)。此外,已經證明,雙分子層中magainin的=-螺旋的方向取決于肽與脂質的摩爾比,在上述化學計量比下,螺旋應垂直于膜表面插入,在含PG的膜中形成孔(Ludtke等人,1996)。這些孔不僅由兩親螺旋的極性面組成,而且還由脂質的極性頭基組成,內外單層通過這些孔襯脂質是連續的。膜中的這種結構可能會降低探針芘部分微環境的極性,從而提高其量子產率。有趣的是,當XPG>0.1時,magainin 2逐漸降低Ie/Im值(圖3 A),這與增強的酰基鏈順序減少脂質側向擴散的速率一致。然而,由于magainin 2已經在XPG=0.1時增加了r,Ie/Im沒有變化,我們可以得出結論,PPDPG探針向微區富集以及其橫向擴散的減少正在發生。
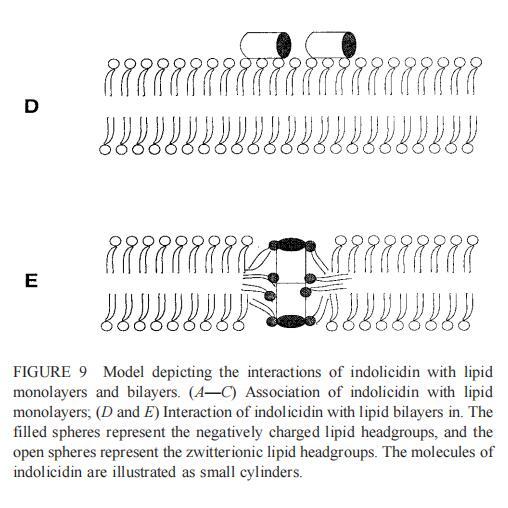
與magainin 2類似,吲哚青霉素與陰離子和兩性離子囊泡的膜結合非常不同(圖1b、4和5),與先前的平衡透析研究一致(Ladokhin et al.,1997)。雖然芘熒光的猝滅顯示吲哚肽被分配到SOPC雙層中,但對膜酰基鏈順序幾乎沒有影響(圖5)。相反,吲哚西啶與陰離子膜的相互作用導致脂酰鏈順序增加,明顯表現為DPH熒光各向異性增加,并對XPG呈S形依賴(圖5)。與magainin 2相反,吲哚西丁導致芘單體和準分子發射強度顯著平行降低,與脂質成分無關,Ie/Im變化較小(圖4)。相應地,吲哚西丁誘導酸性PG富集到微區。有趣的是,在吲哚西丁/脂質摩爾比為1:20以下,芘Im的減少順序為XPG=0.40.20.10(圖4a),而在吲哚西丁/脂質摩爾比為1:10時,Im的減少對XPG的依賴性相反。這種變化的可能機制如下。在低肽/脂摩爾比時,吲哚西丁似乎被調節到雙層界面(Ladokhin等人,1997),芘標記鏈的鏈反轉(Holopainen等人,1999)使該部分更接近雙層表面,從而允許其與吲哚西丁的基本殘基接觸。后者通過π-陽離子相互作用導致芘部分的碰撞猝滅。然而,隨著XPG的增加,我們可以預期PG頭基與吲哚西丁的堿性殘基發生靜電結合,從而阻止芘與吲哚西丁的陽離子殘基之間的直接接觸。隨著肽濃度的增加,吲哚肽的膜結合以協同方式增強,猝滅效率的逆轉可能涉及雙分子層中脂肽復合物的聚集。因此,在酸性含磷脂的膜中,吲哚對芘的猝滅作用較小。當吲哚肽的濃度增加到肽/脂比1:10以上時,肽將以高度協同的方式并入膜的酰基鏈區域(Ha等人,2000)(圖9 E),而在中性膜中,肽位于界面(圖9 D)。插入吲哚西丁的量取決于雙層中的XPG,導致吲哚西丁的Trp殘基的猝滅占主導地位,與XPG=0.4時Im的顯著減少一致(圖4a)。
馬蓋寧2和吲哚西啶對巨脂質體的影響
細胞質膜通透性被認為是馬加寧和吲哚肽等肽的抗菌作用的原因(Matsuzaki,1998,1999;Sitaram和Nagaraj,1999),并提出了幾種機制模型(綜述見Bechinger,1999)。孔或通道的形成被認為會導致跨膜電位的耗散和脂質不對稱(Falla等人,1996年;Matsuzaki,1998年,1999年;Sitaram和Nagaraj,1999年)。Magainin 2和吲哚肽應按照定義的結構插入脂質雙層,與所有疏水氨基酸形成構象,形成一個表面,然后與膜的疏水核心接觸。因此,這些肽的膜插入迫使磷脂酰基鏈分開。這些肽的抗菌作用還可能包括局部相變,如脂肽膠束從雙層分離,或由于插入肽引起膜曲率的局部變化,這可能導致雙層結構的局部坍塌。在分子水平上,這些過程可能是本文報道的magainin 2和吲哚美辛誘導的巨大囊泡形成的基礎。magainin的裂解活性對靶膜的脂質成分高度敏感,該肽優先結合并滲透陰離子脂質膜(Matsuzaki等人,1991、1993、1995a、1998)。因此,對微生物致死濃度的馬蓋寧不會裂解哺乳動物細胞,因為哺乳動物細胞的質膜外層不含帶負電的磷脂(Ma tsuzaki,1999)。大腸桿菌暴露于magainin會導致細菌表面出現氣泡(Matsuzaki等人,1997年)。在本研究中,觀察到由馬蓋寧2和吲哚青霉素誘導的巨大脂質體的囊泡形成,這代表了它們與脂質雙層結合的更宏觀的變化。重要的是,酸性PG的存在是兩種肽產生囊泡所必需的。巨大脂質體的囊泡形成需要反復應用magainin 2,因此暗示了一種濃度依賴性作用機制。已經證明,在存在magainin的情況下形成的孔隙是短暫的,具有有限的壽命(Matsuzaki等人,1995b)。當附近的孔隙崩解時,可能形成肽和脂質的超分子復合物,從而導致雙層的短暫破壞(圖6)。同時,一些肽分子應該轉移到膜的內部小葉中(Matsuzaki等人,1995a,1996),從而使膜重組和愈合。由于magainin 2而形成的內吞小泡比胞吐更明顯(圖6),這可能與肽在雙層外表面的不對稱應用有關。因此,巨大脂質體的囊泡化可以緩解由于不對稱肽結合和隨后的膜膨脹而導致的雙層不利應變。囊泡化可以降低剩余巨大脂質體膜中的肽濃度,從而減少孔隙形成。隨后,需要繼續向膜中添加magainin 2以引起巨大脂質體的進一步囊泡化(圖6)。
吲哚西丁只含有13個氨基酸,因此太短,無法跨越雙層。然而,該肽可以作為聚集物或帶有相關酸性磷脂的頭尾二聚體橫跨雙層(圖9 E),從而導致膜不穩定性。已經證明,吲哚西丁能夠通過穿過外膜殺死革蘭氏陰性細菌,并通過形成通道破壞細胞質膜(Falla et al.,1996)。與magainin 2的作用相比,吲哚青霉素誘導的內吞小泡較小(圖7)可能反映了這些肽與脂質相互作用的不同模式。一些吲哚肽分子可能會轉移到膜的內部小葉中。除了具有廣譜的抗真菌和抗菌活性外,吲哚西丁對哺乳動物細胞也有毒性(Schluesener等人,1993年;Ahmad等人,1995年)。有趣的是,吲哚西丁對SOPC和SOPC膽固醇巨型脂質體的作用不同。在這一階段,根本原因尚不確定,可能與膽固醇對雙層結構以及吲哚肽在膜中的取向的影響有關。因此,需要進一步的研究來闡明膽固醇對吲哚肽膜結合的影響。
我們的結果表明,在帶負電荷的磷脂存在下,magainin 2對所用生物膜模型的作用顯著增強。除了膜負電荷外,肽/脂質的化學計量也被證明是雙層中馬蓋寧組織的重要決定因素(Ludtke等人,1994)。在低肽/脂質比率下,=-螺旋肽基本上平行于膜表面,并淺穿透膜的疏水核心(Bechinger等人,1993年;Matsuzaki等人,1994年)。該位置將脂質頭基推到一邊,迫使疏水區域形成間隙,而膜變薄以填充間隙(Ludtke et al.,1995)。先前已強調了由magainin形成的孔隙的瞬時性質(Matsuzaki等人,1995b)。膜的局部和瞬時破壞可能需要肽與靶細胞膜的不對稱結合。因此,在magainin與靶細胞質膜雙層的外小葉結合后,該外單分子層的側壓力比內小葉增加。此外,平行于層平面的=-螺旋的表面位置在外層單層中施加曲率應變,導致正的自發曲率。當兩個小葉之間的側壓差大小和與正自發曲率相關的能量超過膜變形所需的能量時,雙分子層不穩定,肽相對于層平面的垂直方向發生重新定向,孔隙打開。這些孔隨后可能在靶體內聚集成超分子結構,如在巨型脂質體中觀察到的(圖6)。因此,孔隙和不穩定狀態將是暫時的,允許雙層愈合。為此,馬格蛋白2在其序列的中間含有一組正電荷。同樣,當該肽在雙層中形成瞬時孔并垂直于膜平面定向時,這些陽離子殘基也可能靜電結合到PG,類似于此處提出的吲哚肽組織(圖9)。原核細胞和真核細胞膜脂質成分的主要區別在于后者富含膽固醇(Op den Kamp,1979)。上述機制也將與膽固醇的存在相兼容,以防止magainin 2的膜擾動作用。更具體地說,膽固醇在人類質膜的兩個小葉之間轉移(觸發器)非常快(Lange et al.,1981)。因此,這種膽固醇的快速易位可以消除在magainin 2結合到后一單層后靶膜內外小葉側壓力的差異。因此,與細菌靶點相比,這種肽在真核細胞中產生毒性作用需要大量的magainin 2(Zasloff,1987)。據估計,真核細胞質膜外小葉的平衡側壓力約為32 mN/m(Demel等人,1975年)。在超過34 mN/m的壓力下,觀察到吲哚西丁高效滲透到單層中,這可能部分解釋了該肽在真核細胞中的溶解作用。此外,哺乳動物質膜的外小葉僅由兩性離子磷脂組成,而細菌膜含有大量帶負電的PG(Op den Kamp,1979)。因此,由于缺乏負電荷和高壓,預計magainin 2與真核細胞質膜的相互作用較弱,而更有效的插入吲哚肽將能夠干擾真核細胞雙層的組織。因此,脂質特異性可能導致這兩種肽的不同毒性。
結論
由于抗菌肽的詳細作用機制尚待闡明,比較兩種結構上不相關的肽吲哚肽和馬蓋寧2對模型生物膜的影響很有意義。盡管它們的構象不同,且前者的長度約為后者的一半,但它們也具有諸如凈正電荷和兩親性等特征,導致它們與磷脂膜結合。酸性磷脂進一步增強了這種相互作用,這可能對它們的抗菌活性很重要。酸性磷脂是這些肽囊泡形成巨大脂質體所必需的,它們都會導致酸性磷脂分離,將它們絡合成超分子簇。同樣,這兩種肽都增加了酰基鏈順序。所有這些作用都與抗菌作用所必需的協同膜結合相一致,可能涉及肽的瞬時跨膜定向。還可能是,它們的抗菌作用需要目標膜最初不對稱地暴露于這些肽中,并與系統放松回到熱力學平衡有關。










