合作客戶/
拜耳公司 |
同濟大學 |
聯合大學 |
美國保潔 |
美國強生 |
瑞士羅氏 |
相關新聞Info
細胞表面PH對于生物多肽生物活化的潛在重要性——摘要、介紹、材料和方法
來源:上海謂載 瀏覽 1179 次 發布時間:2022-01-04
摘要
細胞的糖酵解代謝產生質子,這些質子通過轉運蛋白從細胞質中去除,從而在相鄰的整體溶液和細胞膜表面之間產生pH差。因此,由于不同的糖萼和質子產生能力,組織細胞具有不同的表面pHs。在這項研究中,我們使用具有pH依賴活性的裂解肽作為探針,證明了細胞表面pH在肽-細胞相互作用和肽活化中的作用。適當地,所選擇的肽能夠感知細胞上特定的pH區域,因此對具有不同表面pH的組織細胞表現出不同的活性。對于特定的細胞,隨著質子通道調節器調節細胞表面pH值的升高或降低,pH敏感肽的活性相應地發生變化。機理研究表明,細胞表面pH通過改變膜結合pH敏感肽的二級結構和聚集狀態直接影響肽插入膜。根據正常-癌細胞對之間的細胞表面pH差設計的pH敏感裂解肽對癌細胞具有良好的選擇性。因此,細胞表面pHs可能為設計具有高細胞特異性和選擇性的治療肽提供新的機會。
介紹
細胞的糖酵解代謝產生質子,這些質子通過轉運蛋白(如Na+/H+交換異構體1(NHE1)(1,2))從細胞質中去除。在不限制質子擴散的情況下,噴射出的質子將在無限的外部溶液中被稀釋。然而,哺乳動物細胞表面覆蓋著一層致密的碳水化合物,由膜錨定糖蛋白和糖脂的共軛低聚糖鏈組成,稱為糖萼(3)。由于這些帶負電的大分子的存在,質子在膜-水界面上的擴散確實受到帶負電膜表面水的低介電常數(e)的限制。因此,噴射出的質子很容易擴散到細胞膜表面,但不知何故無法迅速與體積平衡。據估計,該勢壘可使膜表面的質子濃度比本體中的質子濃度高10-6 M,從而在細胞膜表面和相鄰本體溶液之間產生pH差(4,5)。理論上,細胞表面的特定pH區可以通過影響細胞表面電荷、細胞表面的離子積累、細胞膜電位、藥物吸收以及肽/蛋白質與受體的結合對細胞產生重大影響。不幸的是,細胞表面pHs的生物學重要性和潛在的藥學意義被忽視了。
我們知道,肽轉變為結合平面和插入細胞膜是生物活性肽發揮其生物活性的關鍵步驟(6)。在本研究中,選擇一組具有pH依賴性細胞裂解活性的裂解肽(pH敏感裂解肽)作為探針,通過檢測細胞表面pHs影響的肽-細胞相互作用和肽活化來評估細胞表面pHs的藥學意義。
方法和材料
材料
肽(純度>90%)由Genescript公司(美國新澤西州皮斯卡塔韋)合成。將肽溶解在含有10%二甲基亞砜(DMSO)的水中,形成5.0 mM儲備溶液。使用合適的細胞培養基,從儲備溶液中逐漸稀釋制備肽工作溶液。活/死細菌染色試劑盒購自Invitrogen Life Technologies(美國加利福尼亞州卡爾斯巴德)。所有其他化學品均從Sigma-Aldrich Co.(美國密蘇里州圣路易斯)購買。
細胞培養
所有細胞均取自美國類型培養物收集中心(ATCC)。A549和CHO-K1細胞在F12K中生長,NIH/3T3細胞在DMEM中生長,CCD-Lu13細胞在MEM中生長。所有培養基均添加10%胎牛血清(FBS)。細胞在37°C、5%CO2的增濕空氣中培養。
肽的pH敏感性
如前所述(6),在負載鈣黃綠素的大單膜囊泡(LUV)上測試肽的裂解活性。通過將激發和發射波長分別設置為485和530 nm,使用熒光微孔板讀取器監測肽誘導的鈣黃綠素泄漏(通過熒光強度的增加反映)。從LUV釋放的鈣黃綠素表示為F/F0,其中F0和F分別表示在不存在和存在肽的情況下負載鈣黃綠素的LUV的熒光強度。已經證明,pH敏感裂解肽的活性變化通常發生在狹窄的pH范圍內,即所謂的肽轉變pH值,即當肽的凈電荷為零(6)時的pH值,如圖1所示。使用納米試劑(6)測定肽的過渡pH值。簡單地說,用不同pH值(pH=5.0–9.0)的PBS稀釋來自儲備溶液(水中5mM)的肽。對新制備的肽溶液(40 lM)進行短暫(60秒)的超聲處理。使用zeta納米分析儀在超聲處理后立即測量肽溶液的zeta電位。
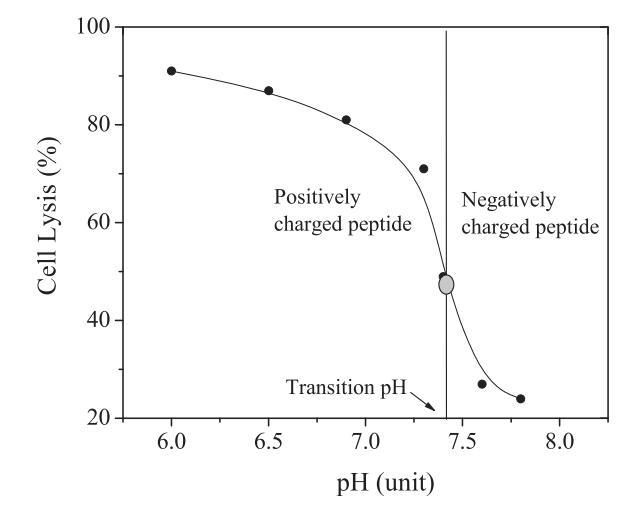
圖1:過渡pH=7.35的肽CL-7的pH依賴性膜裂解活性。
細胞表面pHs的測量
共有2.59105個細胞接種在膠原涂層的覆蓋玻璃上并培養過夜。細胞在無血清培養基中用熒光素結合麥胚凝集素(WGA)(12.5 lM)染色30 min,然后將蓋玻璃組裝到FCS2流動室系統(BioTechs Inc.,Butler,PA,USA)。使用視頻成像技術測量pH值。將蓋玻璃置于共焦顯微鏡(LSM510;美國紐約桑伍德卡爾蔡司有限公司)的臺上,并以0.1ml/min的速度連續超灌注預熱(37°C)Hepes緩沖林格溶液(122.5mmNaCl、5.4mmKCl、0.8mmMgCl2、1.2mmCaCl2、1.0mmNaH2PO4·2H2O、5.0mm葡萄糖、10mmHEPES;pH=7.4)波長在458和488 nm之間交替,而發射的熒光強度記錄在560 nm以上。根據在458和488 nm處測得的發射熒光強度計算出比率。因此,該測量實際上與給定感興趣區域中激發的染料量無關,并表示局部質子濃度(1)。以1.0秒的間隔測量熒光強度,平均測量10次,并通過減去位于測量的感興趣區域旁邊的對照區域的背景強度來校正背景熒光。在每個實驗結束時,通過使用不同pH值(pH=8.5、8.0、7.4、7.0、6.5和6.0)的改良Ringer溶液(125 mM KCl、1 mM MgCl2、1 mM CaCl2、20 mM Hepes和10 mM nigericin)連續超濾池,校準pH測量值。熒光素在6-10的pH范圍內具有良好的熒光強度-pH相關性。
細胞表面電荷的測定
將細胞接種于濃度為5 9 104個細胞/mL的細胞培養瓶中。培養48小時后,從培養瓶中刮下細胞,用PBS洗滌,并在0.25 M蔗糖溶液中重新懸浮至最終濃度為106個細胞/mL。然后用1%甲苯胺藍染色細胞懸浮液90分鐘。之后,用聚1,1-二甲基-3,5-二甲基哌啶氯化銨(CFC)溶液滴定細胞。根據先前出版物(7)中描述的程序,通過將總電荷與電池數量歸一化來計算電池表面電荷。
肽圓二色光譜的獲取
肽的圓二色譜(CD)光譜記錄在Jasco J-710分光旋光儀上(Jasco公司,美國馬里蘭州伊斯頓)(6)。在25°C條件下,在光程長度為1.0-mm的帶帽石英光學池中掃描CD光譜。以1.0 nm的間隔從250至190 nm收集數據,每個波長的積分時間為2秒。對每次測量的五到十次掃描進行平均、平滑、背景減去,并轉換為平均殘余摩爾橢圓度[h](度cm2 dmol?1)。CDPRO軟件用于分析從CD分光旋光儀獲得的數據。
肽誘導細胞裂解的測定
在暴露于肽之前,在96孔板(5 9 103個細胞/孔)上過夜培養的細胞用PBS洗滌三次。在孵育60分鐘后,通過使用乳酸脫氫酶試劑盒測量受損細胞的乳酸脫氫酶(LDH)釋放,定量評估肽誘導的細胞膜損傷。通過將參考波長設置為690 nm,使用微孔板讀取器(美國VT威努斯基Biotek Inc.)測量490 nm處的吸光度。對照空白對照組和100%裂解對照組,結果均標準化為細胞死亡百分比。
肽誘導細胞膜損傷的動力學
將新鮮胰蛋白酶化的人肺癌A549細胞接種于膠原涂層的八孔玻璃室內(2 9 104個細胞/孔),并培養過夜。試驗前,用PBS清洗細胞三次,并用活/死染色試劑盒染色15分鐘。添加肽后,使用蔡司LSM510共焦顯微鏡(卡爾蔡司公司)在不同時間點記錄細胞圖像。激發波長固定在488 nm,發射波長分別設置為505–530 nm(活細胞)和560 nm(死細胞)。計算捕獲的細胞圖像中綠色像素占總綠色和紅色像素的百分比,以估計細胞膜完整性(8)。
肽與脂膜的相互作用
使用組裝在微槽X上的脂質單層研究肽與細胞膜的相互作用(芬蘭赫爾辛基Kibron公司)(6)。將DPPC/膽固醇/DPPS(50/10/2.5)的脂質混合物溶解在3:1氯仿:甲醇中,形成100 lM脂質溶液。向四孔聚四氟乙烯板中添加1.0 mL PBS,然后滴一滴脂質溶液。有機溶劑蒸發后,在水面形成脂質單層。通過特氟隆板的側孔將肽溶液添加到亞相后,立即記錄肽誘導的表面張力變化。
pH敏感肽對正常細胞和癌細胞的毒性
使用MTT[3-(4,5-二甲基噻唑-2-基)-2,5-二苯基四唑溴化鹽]分析,在癌-正常對(A549和CCD-13Lu)上比較pH敏感和pH不敏感裂解肽對正常和癌細胞的細胞毒性。簡而言之,將完整培養基中的細胞加入96孔板(5 9 103個細胞/孔)中,并在37°C下培養14–16小時。洗滌后,用含有不同濃度肽的無血清培養基喂養細胞,并在37°C下培養2小時。之后,向每個孔中加入10 lL MTT(5 mg/mL)。培養4小時后,通過用含有5%異丙醇和0.1%HCl的10%SDS溶液溶解福爾馬贊并在570 nm(9)處測量吸光度來測定細胞活力。
肽在溶液中的自組裝和聚集特性
使用熒光探針1-苯胺基萘-8-磺酸(1,8-ANS)(6,10)估計肽在溶液中自組裝形成肽聚集體。通過將激發波長設置為369 nm,在熒光微孔板閱讀器(Biotek Inc.)上記錄了460–500 nm處由肽聚集引起的1,8-ANS(20 lM)熒光發射光譜增加。
使用zeta納米分析儀測量肽溶液在不同pH下的粒徑和zeta電位變化。在每次測量之前,肽溶液經過短暫(60秒)的超聲處理。
利用掃描電子顯微鏡(SEM)研究了肽聚集體的形態。將肽溶液裝載到硅片上并孵育30分鐘。用去離子水洗滌后,硅片上的肽樣品涂上金。使用Auriga模塊化橫梁工作站(卡爾蔡司公司)獲取SEM圖像。










