合作客戶/
拜耳公司 |
同濟大學 |
聯合大學 |
美國保潔 |
美國強生 |
瑞士羅氏 |
相關新聞Info
細胞表面PH對于生物多肽生物活化的潛在重要性——結果和討論、結論、致謝!
來源: 瀏覽 1184 次 發布時間:2022-01-04
結果和討論
細胞和探針肽的選擇
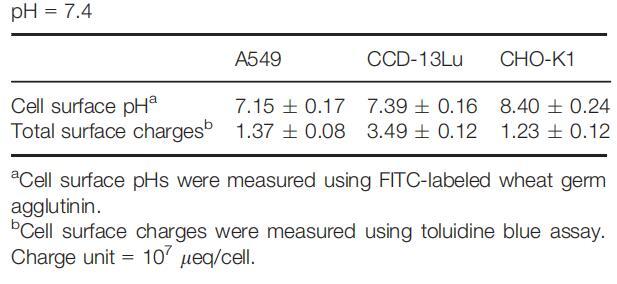
雖然細胞外環境通過影響細胞表面和整體溶液之間的質子交換而影響細胞表面pH值,但在pH值固定的生理條件下,細胞表面pH值將由細胞的化學和生物學特性決定,包括細胞的質子生產能力、細胞大小、細胞的大小、細胞的大小、細胞的大小、細胞的大小、細胞的大小、細胞的大小、細胞的大小、細胞的大小以及細胞的大小,以及細胞表面的pH緩沖能力。因此,在生理條件下,組織細胞可能具有特定的甚至可區分的表面pHs。我們測量了一組來自不同器官/組織的細胞在生理pH下的細胞表面pH值,發現所有受試細胞都具有不同的表面pH值(表1)。
表1:生理條件下測得的細胞表面pH值和電荷
裂解肽是一組陽離子肽,主要作用于細胞膜,通過引起細胞裂解殺死細胞。對裂解肽與細胞相互作用的研究表明,肽向結合平面的轉變和插入膜是裂解肽誘導細胞膜裂解的關鍵(6,9,11)。我們選擇具有pH依賴性細胞裂解活性的裂解肽作為探針,研究細胞表面pH對肽-細胞相互作用的潛在影響。如果pH敏感的裂解肽能夠感應到本體溶液和細胞表面之間的pH差,從而改變肽-細胞相互作用并顯示出改變的細胞裂解活性,則可以評估細胞表面pHs的潛在藥學意義。
我們已經開發了一種構建具有pH依賴性細胞裂解活性的裂解肽的通用方法(9,12)。一些pH敏感的裂解肽表現出高達30倍的活性增加,以響應降低的培養基pH(12)。由于肽對細胞膜的靜電吸引是將肽帶到細胞表面的第一步,也是關鍵步驟,因此肽上的凈電荷將對肽與細胞的相互作用產生顯著影響。在這方面,僅選擇具有相同(+1)電荷的pH敏感裂解肽(表2)。除了電荷外,肽的二級結構還可能顯著影響肽與細胞的相互作用。肽鏈折疊成特定構象(通常為α螺旋結構)證明是肽插入細胞膜的必要且能量有利的過程(6,13)。在本研究中,選擇了具有相同二級結構(a-螺旋)的pH敏感裂解肽。這種肽和細胞選擇使我們能夠直接比較從不同細胞和肽獲得的結果。
表2:所選裂解肽的性質
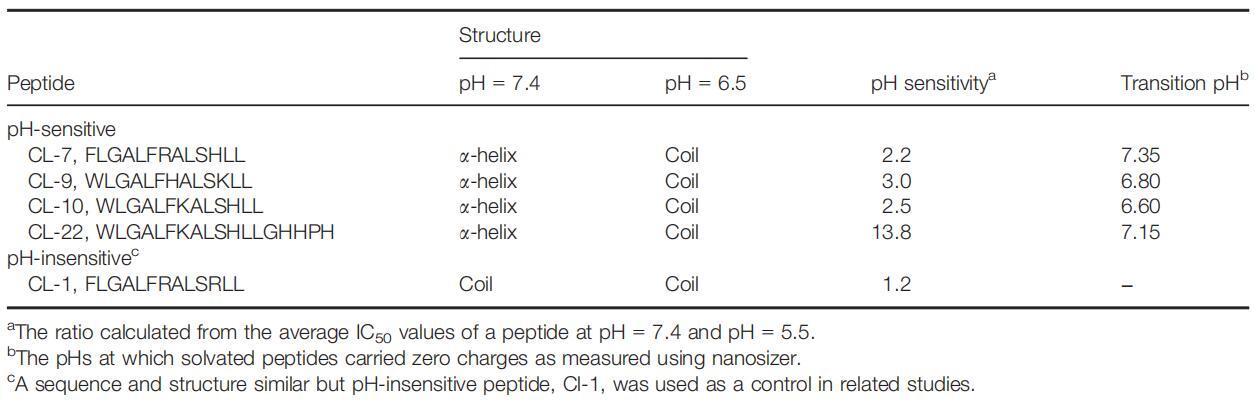
肽CL-1是一種pH不敏感的裂解肽(表2)。盡管其序列和結構與其他pH敏感肽相似,但其細胞裂解活性幾乎不受pH的影響。本研究以肽CL-1作為陰性對照。
pH敏感裂解肽對不同表面pH值細胞的活性
首先在CHO-K1細胞上測試pH敏感裂解肽的活性,測得的細胞表面pH=8.40。由于CHO-K1的表面pH值遠高于所有選定肽的過渡pH值(表2),因此所有肽在從散裝溶液轉移到細胞表面時都會攜帶相同的負電荷(pH=7.4)。四種測試的pH敏感裂解肽在CHO-K1細胞上表現出較低且幾乎相同的細胞裂解能力(圖2)。
圖2:在CHO-K1細胞上測試的pH敏感裂解肽(40 lM)的細胞裂解活性。研究在無血清培養基(pH=7.4)中進行。對照組未添加肽。對照空白對照組和100%裂解對照組,將細胞裂解(乳酸脫氫酶釋放)標準化為細胞死亡百分比。數據代表至少三個獨立測試的平均值和標準差。
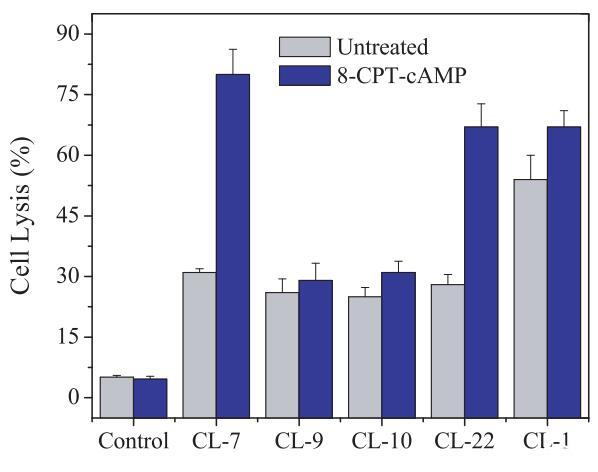
為了研究細胞表面pH對pH敏感裂解肽與細胞相互作用的潛在影響,我們使用質子通道調節劑8-CPT-cAMP(14)調節細胞表面pH。在正常細胞培養條件下,8-CPTcAMP對CHO-K1細胞的活力沒有影響(圖2)。然而,通過8-CPT-cAMP,CHO-K1的細胞表面pH值迅速(在30分鐘內)從pH=8.4降至pH=6.90,而培養基pH值保持不變,保持在pH=7.4(表3)。盡管8-CPT-cAMP處理的CHO-K1細胞的表面pH值仍高于肽CL-9(pH=6.80)和肽CL-10(pH=6.60)的過渡pH值,但低于肽CL-7(pH=7.35)和肽CL-22(pH=7.15)的過渡pH值。有趣的是,四種pH敏感裂解肽對8-CPT-cAMP處理的CHO-K1細胞表現出不同的細胞裂解能力:肽CL-9和CL-10保持與未處理的CHO-K1細胞相同的活性,而肽CL-7和CL-22顯示出顯著增加(約兩倍)的細胞裂解活性(圖2)。肽的活性結果與未處理和8-CPT-CAMP處理的CHO-K1細胞的表面pH值相匹配,表明細胞表面pH值參與pH敏感肽的激活。
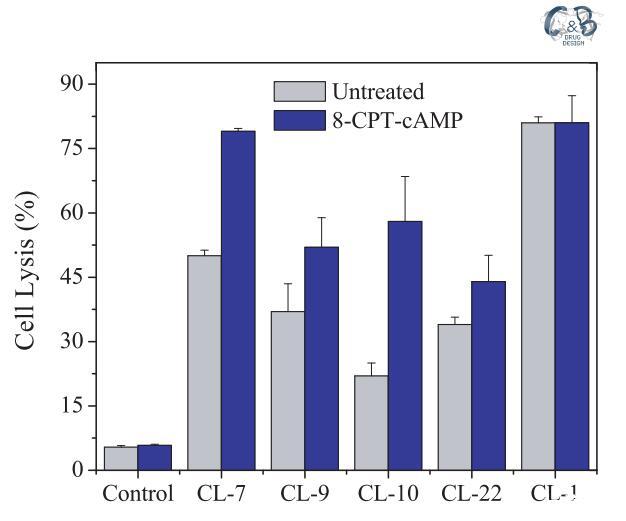
為了排除上述結果由CHO-K1細胞的某些固有特性引起的可能性,我們在另一個選定的細胞A549上進行了相同的實驗,其細胞表面電荷與CHOK1細胞幾乎相同(表1)。由于肽將受到來自A549和CHO-K1細胞的相同拉力,靜電吸引對肽-細胞相互作用的潛在影響被最小化或消除。A549細胞的表面pH值為7.15,高于肽CL-9、CL-10和CL-22的過渡pH值,但低于肽CL-7的過渡pH值(pH值為7.35)。同樣,CL-7被證明是A549細胞上最活躍的肽(圖3)。在存在8-CPT-cAMP的情況下,A549細胞的表面pH值降低至pH=6.55(表3),低于所有受試裂解肽的過渡pH值(表1)。因此,四種pH敏感裂解肽對8-CPTcAMP處理的A549細胞的裂解活性顯著增加(圖3)。應注意的是,與pH敏感肽不同,當細胞被8-CPT-cAMP處理時,pH不敏感肽CL-1對A549和CHO-K1細胞的活性幾乎沒有變化(圖2和圖3)。
圖3:在A549細胞上測試的pH敏感裂解肽(40 lM)的細胞裂解活性。研究在無血清培養基(pH=7.4)中進行。對照組未添加肽。對照空白對照組和100%裂解對照組,將細胞裂解(乳酸脫氫酶釋放)標準化為細胞死亡百分比。數據代表至少三個獨立測試的平均值和標準差。
細胞表面pHs影響肽活化的進一步證據來自使用另一種質子通道調節劑巴絲霉素A1(15)的類似研究。與8-CPT-cAMP一樣,巴非霉素A1對細胞活力的影響非常有限(圖4),但巴非霉素A1處理導致細胞表面pHs增加。此外,巴非霉素A1能夠逆轉8-CPT-cAMP對細胞的影響,并使細胞表面pHs恢復到正常水平或更高水平(表3)。研究表明,最初在8-CPT-cAMP處理的細胞上觀察到的肽的細胞裂解活性的升高被逆轉,因為細胞表面pH值的增加超過了巴絲霉素A1的肽的過渡pH值(圖4)。
表3:8-CPT-cAMP-和巴非霉素A1在具有生理pH的培養基中誘導的細胞表面pH變化
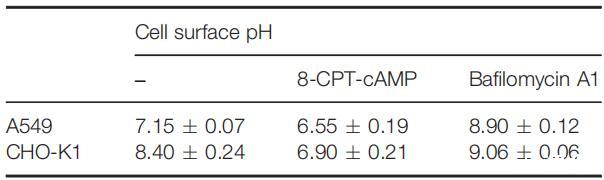
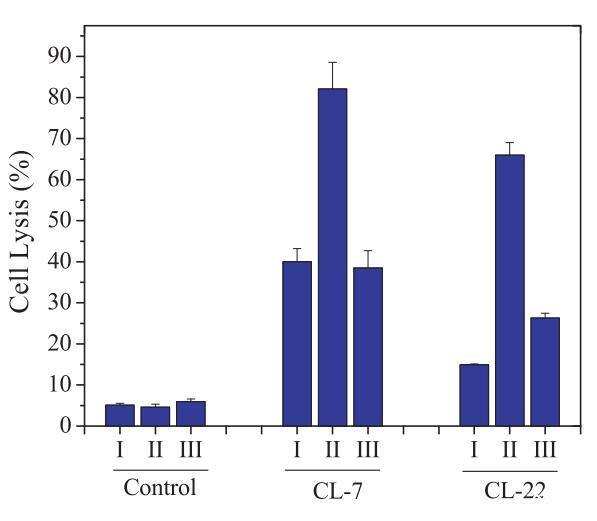
圖4:在CHO-K1細胞(I)、用8-CPT-cAMP處理的CHO-K1細胞(II)和用8-CPT-cAMP處理的CHO-K1細胞上測試的細胞表面pHs調節PH敏感裂解肽CL-7和CL-22的細胞裂解活性,然后是巴絲霉素A1(III)。表3提供了不同處理對應的細胞表面pHs。在所有實驗中,肽濃度固定在40 lM。對照組未添加肽。對照空白對照組和100%裂解對照組,將細胞裂解(乳酸脫氫酶釋放)標準化為細胞死亡百分比。數據代表至少三個獨立測試的平均值和標準差。
機理研究
肽與細胞膜的相互作用包括三個步驟:(i)陽離子肽對細胞表面的靜電吸引;(ii)肽向結合平面的轉變;(iii)將肽插入細胞膜。通過研究pH敏感肽CL-7誘導的膜損傷動力學,研究了肽-細胞相互作用的細節(圖5A)。CL-7誘導的A549細胞膜滲漏呈時間依賴性,并呈線性曲線。盡管在8-CPT-cAMP處理的A549細胞上,CL-7介導的細胞膜損傷在開始時遵循相同的曲線,但它偏離了線性曲線,并在培養15-20分鐘后加速(圖5A)。在脂質單層膜上進行的平行膜張力研究表明,CL-7與細胞膜的相互作用以表面張力快速增加的初始階段為特征,隨后是表面張力松弛的第二階段(圖5B),與肽與膜結合和肽插入相關膜,分別。盡管CL-7與脂膜結合是一個快速過程(3-5分鐘),但肽插入脂膜大約需要20分鐘才能完成。這兩個實驗的結果非常吻合,這意味著細胞表面pH對CL-7的顯著影響發生在肽-細胞相互作用的后期,即肽插入細胞膜。
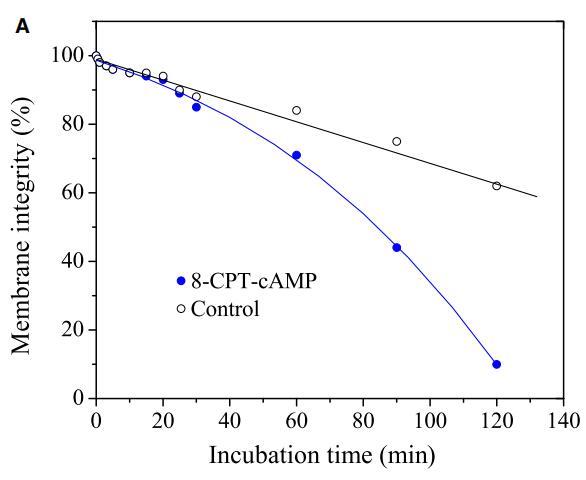
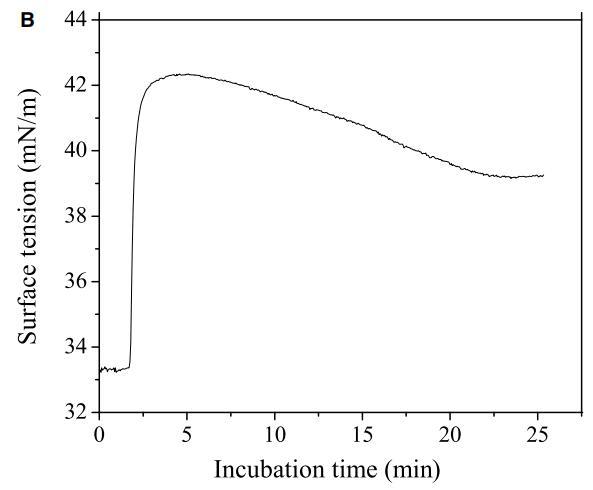
圖5:(A)使用活/死試劑盒測定的肽CL-7誘導A549細胞膜損傷的動力學。在不同時間點添加肽溶液后拍攝熒光圖像。計算綠色像素占總綠色和紅色像素的百分比,以估計細胞膜的完整性。(B)肽CL-7結合和插入引起脂質單層的表面張力變化(DPPC/膽固醇/DPPS=50/10/2.5)。肽濃度保持在10 lM,脂質單層的初始表面張力設定為33 mN/m。
我們知道,由于肽上的凈正電荷減少,含有組氨酸的pH敏感肽傾向于聚集,并且可以自組裝成具有特定結構的肽聚集體(8,9,16)。在不同pH下聚集改變的肽是含組氨酸肽(6,9)pH依賴性活性的主要原因。使用1,8-ANS作為肽聚集體的疏水“口袋”探針的研究(圖6A)表明,肽CL-7在生理pH下經歷了自組裝,如1,8-ANS在500 nm處的高發射強度和顯著藍移所示。使用SEM觀察由纖維狀超分子和納米顆粒組成的CL-7聚集體(圖6B)。然而,與其他含組氨酸的肽一樣,CL-7聚集體不穩定,在酸性條件下溶解,因為組氨酸殘基的咪唑基被質子化,并且肽分子之間的分子間排斥作用恢復(圖6A)。這種pH值控制的CL-7聚集和溶解通過在高濃度(80 lM)肽溶液中進行的顆粒分析得到證實(圖6C)。與肽聚集體(6,9)相比,自由形式的肽具有更高的膜親和力和膜插入能力,這解釋了pH敏感裂解肽對具有酸性表面pHs的細胞的強烈活性(圖2、3和4)。
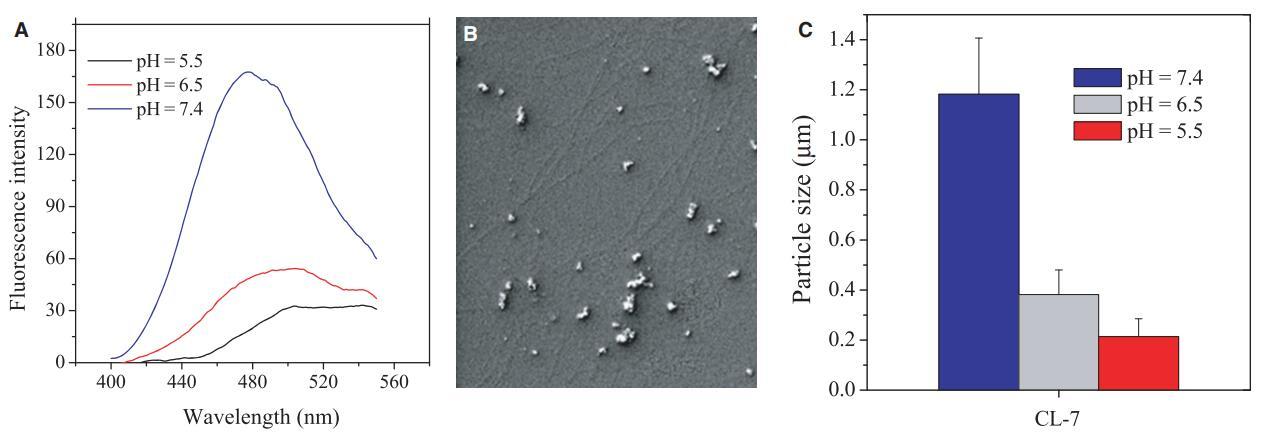
圖6:(A)pH值影響不同pH值下溶液(40 lM)中CL-7的聚集。1-苯胺基萘-8-磺酸(1,8-ANS)濃度固定在20 lM,激發波長設置為369 nm。肽聚集溶解通過1,8-ANS發射峰在500 nm處的紅移和熒光強度降低來指示;(B)pH=7.4的40 lM肽溶液中形成的CL-7聚集體的掃描電子顯微鏡圖像;(C)隔夜培養后測量溶液中肽CL-7(80 lM)的粒徑。數據代表至少三個獨立測試的平均值和標準差。
除了肽聚集狀態外,細胞表面pH值也可能影響pH敏感肽的二級結構。已經發現,肽插入細胞膜通常伴隨著肽二級結構的變化(17)。肽鏈折疊成特定構象,通常為α螺旋結構,這被證明是肽插入細胞膜的必要過程(6)。盡管所有選定的pH敏感裂解肽在生理pH下均采用螺旋結構,但當環境pH降至肽的過渡pH以下時,它們變成隨機線圈(表2和圖7)。從無規螺旋轉變為螺旋是肽插入膜的能量有利過程(6)。因此,細胞表面pH值也可能通過改變pH敏感肽的二級結構而影響其活性。
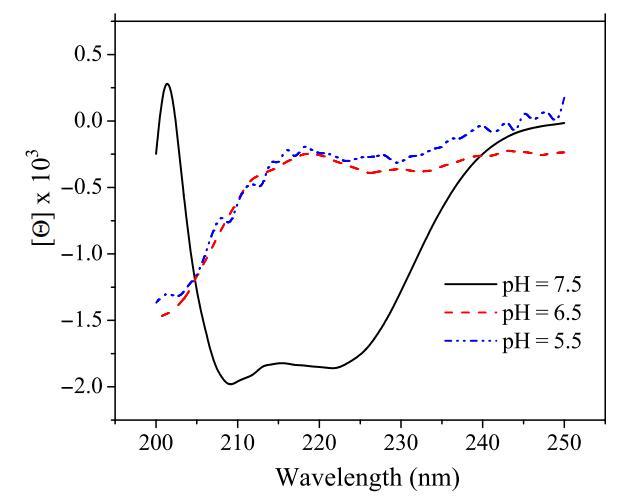
圖7:pHs影響肽CL-7在20mM NaAc溶液中測得的圓二色譜光譜變化。以1.0 nm的間隔從250至190 nm收集數據,每個波長的積分時間為2秒。對五到十次掃描進行平均、平滑、背景減去,并轉換為平均殘余摩爾橢圓度(h)[度數/(cm2 dmol?1)]。
pH敏感肽對腫瘤的選擇性
細胞表面pHs參與肽活化為設計具有所需細胞選擇性的治療性肽提供了新的機會。我們知道癌細胞通常具有較高的新陳代謝和較高的細胞表面緩沖能力(18)。因此,與正常細胞相比,癌細胞可能具有更多的酸性表面pHs。在我們研究中包括的正常-癌細胞對CCD-13Lu和A549之間,人肺癌細胞A549的表面pH值(pH=7.15)比正常人肺癌細胞CCD-13Lu(pH=7.4)的表面pH值(表1)高。盡管表面pH值差異如此之小,但它確實為我們提供了一個機會來測試利用細胞表面pH值來改善癌癥治療的可行性。
在細胞毒性研究中,選擇了研究充分的pH敏感裂解肽PTP-7b(FLGALFKALSHL)(6,9)。由于PTP-7b的過渡pH(pH=7.25)低于A549的表面pH,但高于CCD-13Lu,因此裂解肽PTP-7b對A549的毒性可能比對CCD-13Lu細胞的毒性更大。選擇PTP-7b的親本肽PTP-7(FLGALFKALSKLL),一種pH不敏感的裂解肽(6,9)作為對照。如圖8所示,盡管肽PTP-7對兩種細胞的活性相同,但pH敏感肽PTP-7b對A549的毒性大約是對CCD-13Lu的三倍。
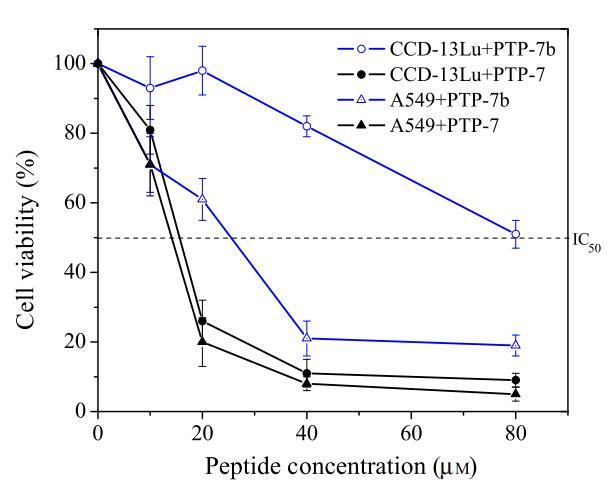
圖8:pH敏感肽PTP-7b(FLGALFKALSHLL)對正常-癌細胞對CCD-13Lu和A549細胞的細胞毒性(MTT試驗)。以pH不敏感肽PTP-7(FLGALFKALSKLL)作為對照。數據代表至少三個獨立測試的平均值和標準差。
我們知道,與蛋白質相比,肽具有一些獨特和優越的特性(19)。生物活性肽對生物體的功能和條件有積極的影響,并顯示出對人類健康有益的特性。在過去的十年中,肽的研究得到了迅速的發展,而且這種發展很可能會繼續下去。獨特和特異的細胞表面pH值可能是設計具有所需細胞特異性和選擇性的藥物和治療肽的新靶點。
致謝
這項工作得到了美國國立衛生研究院GM081874撥款的支持。陳先生是創新創業博士研究生獎學金的獲得者。










