合作客戶/
拜耳公司 |
同濟大學 |
聯合大學 |
美國保潔 |
美國強生 |
瑞士羅氏 |
相關新聞Info
酯功能化的雙子表面活性劑與血紅蛋白的結合——摘要、簡介
來源:上海謂載 瀏覽 843 次 發布時間:2021-11-15
摘要
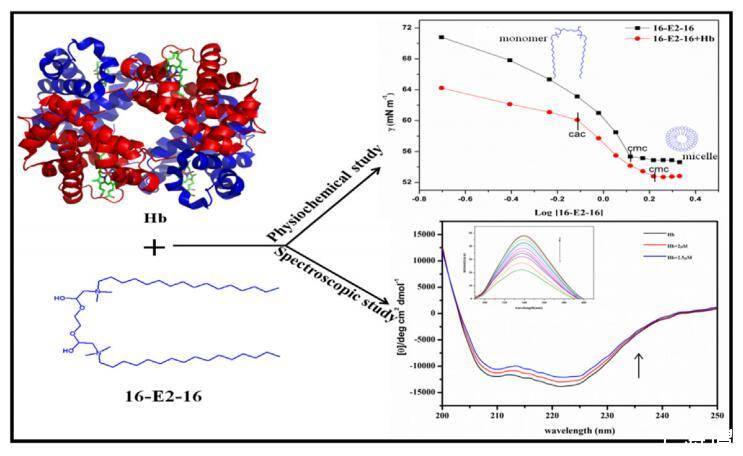
熒光、紫外-可見光、圓二色性 (CD) 光譜和表面張力技術 用于研究血紅蛋白 (Hb) 和雙子表面活性劑 bis (N, N-二甲基-N-十六烷基乙酸銨)二氯化物(16-E2-16)。 分子對接與模擬 還研究了與 16-E2-16 相互作用時 Hb 構象的變化。 這 UV-vis 研究證明了 soret/血紅素帶的擾動,并在 16-E2-16 存在的情況下在血紅素組內產生構象異質性。 數據顯示熒光增加 添加 16-E2-16 后 Hb 的強度。 16-E2-16的cmc值后熒光 強度緩慢增加。 Trp 熒光比 Tyr 的影響更大。 臨界膠束 測定了不同溫度下 Hb 不存在和存在時 16-E2-16 的濃度 使用表面張力圖。 cmc 隨溫度升高以及存在而增加 的 Hb。 此外,還研究了膠束化的熱力學參數。 對接研究 表明 16-E2-16 結合 Hb 的 α1 和 β2 鏈,主要作用力是疏水的 和靜電。 模擬和 CD 研究證實了結合后 Hb 的構象變化 與 16-E2-16。
一、簡介
在所有血紅素蛋白中,血紅蛋白是被廣泛研究的蛋白質。 它由兩條α鏈和兩條β鏈組成, 每條鏈形成一個疏水空間,保護血紅素 來自水的單體 [1]。 它的分子量為 64.5 KDa 和 含有大量可電離的氨基酸,這使得它 極易溶于水。 發現血紅蛋白結合許多不同類型的兩親分子,這些分子起重要作用 在確定生理功能 [2-7]。 因為,許多不同的兩親組件,如膠束、囊泡、管和層狀 液晶等常用于模擬一些生物系統,因此它們與 Hb 的相互作用可以提供有趣的 有關 Hb 的熱力學、結構、生物醫學和生物物理信息 [8-10]。 與他人互動的研究 分子,如細菌內毒素 [11,12]、羥基脲 [13] 和海藻糖 [14],表明某些生物分子可以 將氧合血紅蛋白 (oxyHb) 轉化為高鐵血紅蛋白 (metHb) 和 半色素,而其他一些可能減緩或逆轉 Hb 的自氧化過程 [12,14]。
蛋白質與表面活性劑的相互作用很常見 在化學、生物學和醫學領域[15-17]。 超過 在過去的幾十年里,蛋白質-表面活性劑的相互作用 由于其在工業、生物學和制藥方面的重要性而成為廣泛研究的主題 [18,19]。 有關的信息 蛋白質-表面活性劑復合物的結構已經推導出來 來自流變學 [20]、光譜學 [20,21]、電泳 [22]、 結合 [23,24] 和散射研究 [25,26]。 最近,該研究 表面活性劑與蛋白質相互作用的研究 表面活性劑-蛋白質復合物結構及其變化 蛋白質結構。 疏水相互作用、靜電相互作用、范德華力和氫鍵起著重要作用 在配體-蛋白質結合中的作用 [27]。 疏水性促進水 去除并支持蛋白質-配體相互作用,但它也調節介電效應。 如果蛋白質和配體帶有一些電荷 那么靜電相互作用確實在蛋白質配體結合中起重要作用。 范德華相互作用形成于 永久偶極子或相應的感應偶極子相互作用。 這 這些相互作用的影響在可極化基團中最高 蛋白質,它包括存在于 疏水性氨基酸,如亮氨酸和纈氨酸。 這種互動 與距離有關,并隨著距離增加 5? 而減少。 在蛋白質-配體相互作用中,氫鍵也起著重要作用。 Babine 和 Bender 報道了氫鍵 對蛋白質-配體復合物的穩定性有很大貢獻[28]。
一般而言,CMC以下的離子表面活性劑(陽離子和陰離子) 與蛋白質的帶相反電荷的殘基結合。 陽離子表面活性劑通常與谷氨酸 (glu) 和天冬氨酸 (asp) 結合 蛋白質的殘基與它們產生靜電和疏水相互作用。 隨著表面活性劑的濃度 增加,表面活性劑分子開始形成簇 使蛋白質的結合位點飽和,從而導致蛋白質解折疊。 這些簇經常與蛋白質分子相互作用 穩定他們。 蛋白質通過表面活性劑展開 取決于表面活性劑濃度之間的比率 和蛋白質,這個比例決定了多少表面活性劑可用 每個蛋白質分子。 因此,展開隨著增加 表面活性劑分子的濃度,在這個階段表面活性劑 作為典型的變性劑 [29]。
最近,已經設計和開發了新的表面活性劑。 這些表面活性劑由兩條疏水鏈和 兩個極性頭部基團通過間隔基團共價連接 [30–33]。 這種新型表面活性劑被稱為雙子表面活性劑。 它們表現出與傳統表面活性劑不同的特性, 例如較低的臨界膠束濃度 (cmc)、對間隔結構的強烈依賴、特殊的聚集體形態和強疏水微域 [34,35]。 因此,相比 與常規表面活性劑相比,雙子表面活性劑表現出不同的 與蛋白質的行為。 此外,雙子表面活性劑可以減少洗滌劑對環境的影響, 因為執行相同的操作所需的量要少得多 功能。 此外,它們不尋常的效率和化學多功能性將 對設計新型濃縮洗滌劑有很大的方便。 我們小組最近致力于研究雙子表面活性劑與不同蛋白質的相互作用 [36-38]。
繼續,在此,我們研究了基于酯的相互作用 陽離子雙子表面活性劑 (16-E2-16) 與 Hb 使用表面張力、UV-vis 和熒光。 16-E2-16 中含有一個酯鍵 并且發現在本質上是可切割的,因為較高的 極性鍵有助于提高水溶性,使其 容易降解 [39,40] 間隔基中的酯鍵使 與其他陽離子表面活性劑相比,gemini 更易裂解、可生物降解且水生毒性更低 [41,42]。 還有酯 雙子座中的鍵促進與蛋白質的氫鍵結合 [38]。
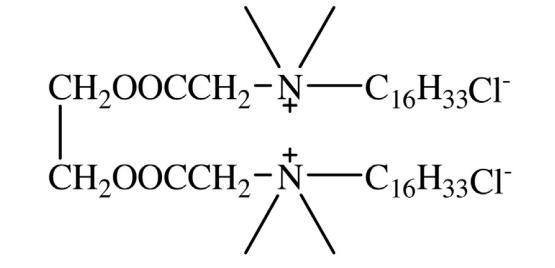
方案 1. 16-E2-16 的結構。