合作客戶/
拜耳公司 |
同濟大學 |
聯合大學 |
美國保潔 |
美國強生 |
瑞士羅氏 |
相關新聞Info
細胞膜表面張力調控方法與步驟
來源:南京郵電大學 瀏覽 372 次 發布時間:2024-03-11
細胞膜是由蛋白質與膽固醇等分子鑲嵌在磷脂中的典型雙分子層結構。細胞膜仿生技術已經成功實現在納米顆粒以及納米液滴表面修飾組裝,并實現體內的長循環以及良好生物相容性。典型的細胞膜仿生技術是將剝離后的細胞膜直接以磷脂雙分子層的形式包被于納米顆粒或液滴表面。然而由于表面張力作用,細胞膜的磷脂雙分子層無法直接包被在微米級的氣泡表面。
本發明采用反復液氮冷凍-室溫融化的方式向血小板膜中摻雜磷脂并得到血小板膜凍融復合物囊泡。通過Langmuir-Blodgett膜天平測試得到凍融復合物中的磷脂蛋白質分子在氣液界面的表面張力顯著降低,通過差適量熱掃描技術測試表明摻雜后的血小板膜玻璃態轉變溫度降低。利用超聲輔助的方式向血小板膜凍融復合物囊泡中鼓入六氟化硫氣體,在氣液界面形成血小板膜凍融復合物微泡。通過熒光標記的方式定位血小板膜蛋白,并成功示蹤其融合在血小板膜凍融復合物微泡。通過對血小板膜凍融復合物囊泡以及血小板膜凍融復合物微泡進行蛋白質組學分析,發現血小板膜凍融復合物微泡繼承了血小板膜凍融復合物囊泡61.4%的蛋白質種類,并維持了血小板膜表面的整合素αIIβ3活化的構象。在大鼠下腔靜脈急慢性血栓模型實驗中,血小板膜凍融復合物微泡能夠特異性識別急性血栓,其對于急性血栓診斷平均信噪比為12.47 dB,而慢性血栓為0.1dB。
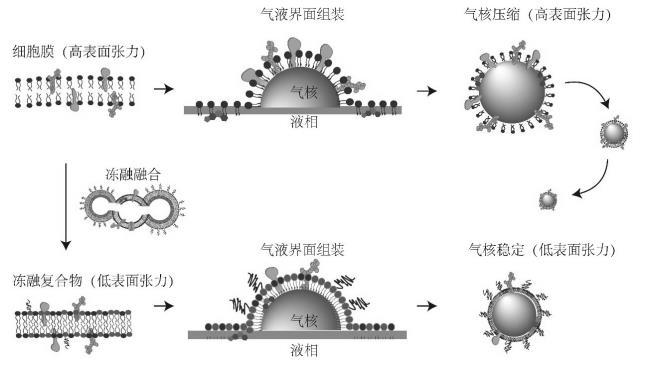
細胞膜表面張力調控方法示意圖;
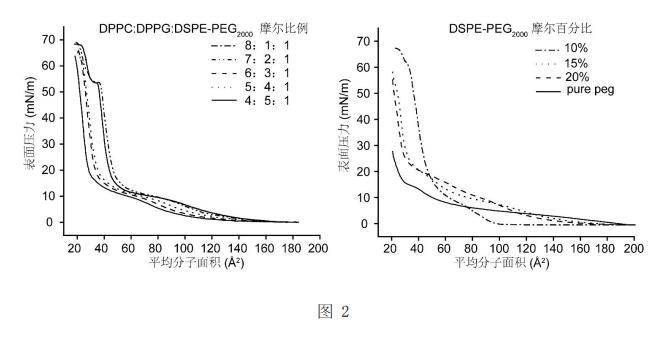
不同磷脂配方的脂質體對氣液界面表面張力調控效應的表面壓力與面積等溫曲線圖;
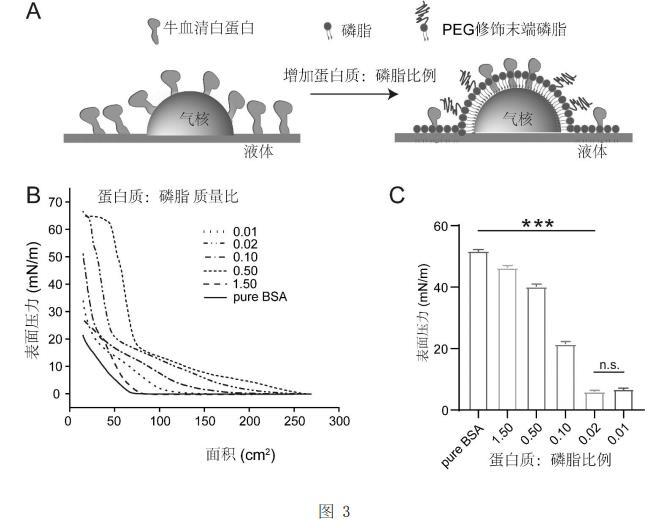
不同蛋白質與磷脂質量比對氣液界面表面張力調控效應圖:A為牛血清白蛋白與磷脂在氣液界面組裝的示意圖;B為不同蛋白質與磷脂質量比的氣液界面表面壓力與面積等溫曲線圖;C為不同蛋白質與磷脂質量比的表面張力值;
實施例:
1、血小板膜的提取:
首先從人、大鼠、小鼠、兔、牛、豬的全血中選取血小板,所選的磷脂為二棕櫚酸磷脂酰膽堿、二硬脂酸磷脂酰乙胺醇-聚乙二醇2000、硬脂酸、二硬脂酸磷脂甘油的組合;然后,在全血提取出的血小板中,加入終濃度為42 mM的甘露糖、終濃度為1μM的前列腺素E1,和磷酸酶蛋白酶抑制劑混合物,得到濃度為2×108
個/mL的血小板懸液。將血小板懸液在-80°C冰箱中冷凍1小時,隨后在37°C恒溫水浴箱中融化,反復三次后于4°C,12000g條件下離心15分鐘得到血小板膜懸液,并用BCA蛋白定量試劑盒定量蛋白質濃度,用磷脂試劑盒定量磷脂濃度。
2、磷脂的制備:
磷脂按照二棕櫚酸磷脂酰膽堿、二硬脂酸磷脂酰乙胺醇-聚乙二醇2000、硬脂酸、二硬脂酸磷脂甘油的以一系列質量比例溶解在體積比為1:1的氯仿和甲醇中,于50℃,100rpm的條件下旋蒸直到圓底燒瓶底部出現一層均勻的薄膜,取下燒瓶,真空干燥8小時。往干燥后的燒瓶中加入磷酸緩沖液并在50℃、100 w、53 kHZ的條件下水浴超聲得到脂質體膜溶液,并調節脂質體膜溶液的PH為7.4。將血小板膜與脂質體在不同的蛋白質磷脂質量比例下進行混合。將混合物在液氮和室溫下反復凍融6次得到血小板膜凍融復合物。將血小板膜或血小板膜凍融復合物轉移到置于冰上的10 mL玻璃瓶中,將六氟化硫氣體吹入系統,用探針超聲處理(300 W,5 s開/5 s關)將六氟化硫氣體分散到水性介質中4個循環分別得到血小板膜納泡以及血小板膜凍融復合物微泡。
3、蛋白質磷脂復合物氣液界面張力調控:
采用Langmuir-Blodgett多功能膜天平測量所制備磷脂復合物在氣液界面處的表面張力。用微量注射器將20μL磷脂(1mg/mL脂濃度)氯仿溶液涂在Langmuir-Blodgett多功能膜天平上,使氯仿蒸發10分鐘。將表面的初始面積設置為282 cm2
,并在20℃下以10 mm/min的速率壓縮薄膜,記錄表面張力-表面積曲線。如圖2所示在一系列磷脂配方中,DSPE-PEG2000
的摩爾百分比為10%時在氣液界面具有最低的表面張力(3mN/m),DPPC:DPPG:DSPE-PEG2000
的比例為8:1:1的時候氣液界面的的表面壓力達到69mN/m,因此具有最低的氣液界面表面張力(2mN/m)。為了探究蛋白質與磷脂在氣液界面組裝的規律,如圖3中的A所示,選用牛血清白蛋白(BSA)作為標準蛋白質,配置好一系列不同蛋白質與磷脂質量比的磷脂蛋白質復合物,并用微量注射器將20μL磷脂蛋白質復合物(1mg/mL脂濃度)氯仿溶液涂在Langmuir-Blodgett多功能膜天平上,使氯仿蒸發10分鐘。將表面的初始面積設置為282cm2
,并在20℃下以10 mm/min的速率壓縮薄膜,記錄表面張力-表面積曲線。如圖3中的B以及C所示在一系列具有不同質量比的磷脂蛋白質復合物中當蛋白質比磷脂的質量比為0.02時具有最低的氣液界面表面張力。
4、血小板膜-磷脂融合驗證:
分別用過量的DiO和DiI對血小板膜囊泡和脂質體進行染色,隨后用12000 g,15min,4℃的條件去除未嵌膜的染料。按照不同蛋白質:磷脂質量比添加兩種膜材并在37℃恒溫箱中共孵育30分鐘,取出后在液氮中放置1分鐘,隨后放置于37℃融化,重復該循環5次。凍融循環后的凍融復合物溶液置于冰上,用功率為10 w,頻率為25 Khz的探頭超聲,控制超聲5秒開時間,5秒關時間,總時間為2分鐘,得到熒光標記血小板膜凍融復合物囊泡。在3 ml的石英比色皿加入2 ml水和20 ul樣品,用460 nm波長的激光作為激發光,接收480-680 nm的發射光。如圖4中的A所示由于DiI與DiO分子在距離小于10 nm時會發生Foster熒光共振能量轉移(FRET)現象,嵌在磷脂雙分子層中疏水端的分子彼此接近且小于10nm可以證明血小板膜與脂質體的磷脂進行了相互的融合。如圖4中的B所示,隨著蛋白質與磷脂的質量比降低熒光共振轉移現象逐漸明顯,說明膜融合的程度增大。分別用過量的DiO和DiD對血小板膜囊泡和脂質體進行染色,隨后用12000 g,15 min,4℃的條件去除未嵌膜的染料。將染色后的血小板囊泡以及脂質體在蛋白質與磷脂的質量比為0.02時分別通過混合孵育以及凍融兩種方式進行融合,通過流式細胞術來觀察兩者融合效率,如圖4中的C所示,當血小板囊泡與脂質體形成凍融復合物可以有效融合兩種組分。取不同膜蛋白:脂質體的質量比的血小板膜凍融復合物微泡進行凍干,凍干粉進行差示量熱掃描分析,掃描速度為5℃/min。如圖5所示,隨著摻雜磷脂的比例增加,血小板膜凍融復合物的玻璃態轉變溫度降低,在蛋白質與磷脂的質量比為0.02時候具有最低的玻璃態轉變溫度。血小板膜氣液界面張力調控。使用凍融的方法向血小板膜中摻雜不同比例的磷脂,形成凍融復合物,其組分的構成如圖6所示。向血小板膜中摻雜不同比例的磷脂,形成的血小板膜凍融復合物在氣液界面的表面張力隨著蛋白質與磷脂質量比的降低而降低,如圖7所示血小板膜凍融復合物在蛋白質與磷脂的質量比為0.02時具有最低的氣液界面表面張力。
5、血小板膜氣液界面組裝組分的定位:
血小板膜用Cy5.5進行蛋白標記,用于在氣液界面組裝過程中進行組分定位。將血小板膜、血小板膜凍融復合物或血小板膜和脂質體的混合物在SF6
氣氛中超聲乳化。得到的氣泡用于流式細胞術分析,在FSC/SSC門控中分離所得氣泡,并定量Q2和Q4區域的Cy5.5熒光,如圖8所示,相對于血小板膜與脂質體的混合物使用血小板膜凍融復合物可以有效將血小板膜組分組裝在微米氣泡上。對于熒光定位分析,用Cy5.5標記血小板膜組分進行定向。將所有囊泡系統在超聲處理前以12000g離心10分鐘,超聲處理后以50g離心10分鐘,并通過小動物體內成像系統(IVIS)成像以檢測Cy5.5信號。超聲處理后,通過Zetasizer測量原始混合物和離心管中頂部或向下部分的粒徑。如圖9所示,使用血小板膜凍融復合物制備的微泡中檢測到標記血小板膜的熒光分子Cy5.5。
6、制備過程產物形貌及電位表征:
采用透射電子顯微鏡對血小板膜、血小板膜凍融復合物、血小板膜納泡和血小板膜凍融復合物微泡的形貌進行表征。將所有樣品稀釋至0.1 mg/mL(脂質濃度)。將10μL的血小板膜和血小板膜凍融復合物滴落到碳涂層銅網上。真空干燥15分鐘后,用1%醋酸鈾對樣品進行負染。將10μL的PNBs和PMBs在室溫下滴落在碳包覆的銅網格上2 h,使其吸附到碳膜表面。使用透射電子顯微鏡在100 kV的加速電壓下檢查所有樣品。如圖10所示,血小板膜(A)與血小板膜(C)具有典型的磷脂雙分子層結構,而在血小板膜納米泡(B)以及血小板膜凍融復合物微泡(D)具有典型的單分子層氣泡結構。通過Zetasizer測量血小板膜、血小板膜凍融復合物、血小板膜納泡和血小板膜凍融復合物微泡的水合粒徑和zeta電位,如圖11所示,血小板膜與血小板膜納泡具有相似的zeta電位,在摻雜磷脂后血小板膜凍融復合物以及血小板膜凍融復合物微泡的zeta電位有明顯降低降低為-47mV。
7、血小板膜凍融復合物微泡蛋白表征:
對制備的血小板膜凍融復合物與血小板膜凍融復合物微泡進行蛋白質組學分析,如圖12所示,血小板膜凍融復合物微泡繼承了血小板膜凍融復合物61.7%的蛋白質種類。將制備的血小板膜凍融復合物微泡與FITC標記的CD41抗體先渦旋混合2分鐘,再放于37°C中緩慢攪拌孵育30分鐘。平行組再用膜染料DiI非特異性地染磷脂,取出后在200g,2分鐘的離心條件將微氣泡與未結合的抗體分離。取微氣泡稀釋20倍后滴于帶有凹槽的載玻片中,再蓋上蓋玻片,分別用484nm和559nm的激發光源拍攝共聚焦顯微鏡。如圖13所示,在血小板膜凍融復合物微泡中來自血小板膜的綠色熒光與來自脂質體的紅色熒光有效共定位。
8、血小板膜凍融復合物微泡糖蛋白αIIbβ3蛋白質構象分析:
收集的血小板靜置在Tyrode緩沖液中(5×105
)。將血小板或血小板膜凍融復合物微泡與生理鹽水或凝血酶(0.5 U/mL)在200μL終體積的Tyrode緩沖液中孵育15分鐘。然后用10μL PE-JON/A抗體在室溫下黑暗染色20 min,并在進行流式分析。免疫共沉淀實驗中用0.5 U/mL凝血酶刺激小鼠血小板,加入裂解緩沖液終止反應。然后將活化的血小板裂解物、血小板裂解物、血小板膜凍融復合物裂解物和血小板膜凍融復合物微泡裂解物與抗β3抗體(50μg/mL)在4°C下孵育過夜。次日加入rProtein A/G磁珠吸收免疫復合物。將樣品在磁架上分離,并用裂解緩沖液洗滌6次。使用SDS-聚丙烯酰胺凝膠電泳和含有β3和talin-1抗體的蛋白質印跡分析免疫沉淀。如圖14所示,血小板膜凍融復合物微泡表面的糖蛋白αIIbβ3具有活化的構象,并且其活化不依賴血小板內的Talin-1蛋白。
9、急慢性血栓模型的構建:
用異氟烷麻醉大鼠,開腹后找到下腔靜脈,并用一段長為4 mm,寬為2 mm的濾紙條泡在20%的三氯化鐵中,取出后貼在下腔靜脈表面,1分鐘后取走濾紙條,并用PBS重洗該處,構建大鼠急性血栓模型。在慢性血栓模型中,大鼠的傷口縫合后在無菌環境下飼養10天,構建慢性血栓模型。
10、急慢性血栓模型的超聲分子影像診斷:
超聲造影設備采用GE公司生產的LOGIQ E9型全身應用超高端彩超,首先選用18MHz探頭機械指數MI調節為1.0,在B模式下對下腔靜脈進行造影,對血栓的大小及位置進行判斷,在多普勒模式下對血栓處的血流進行造影。用5 ml注射器抽取5 ml生理鹽水加入到血小板膜凍融復合物微氣泡凍干粉中,用力震蕩復溶形成血小板膜凍融復合物微氣泡。將血小板膜凍融復合物微氣泡通過尾靜脈分別注射入大鼠的尾靜脈中。再選用9 MHz的探頭,機械指數MI調節為0.14,在對比增強模式(CEUS)下對下腔靜脈進行造影,血管灌注及血栓靶向時的對比增強超聲圖像分析。連續采集5分鐘內的圖像,并使用MATLAB軟件對圖像感興趣區域的信號強度進行分析,并根據超聲強度的標尺來確定感興趣區域的超聲信號值。如圖15所示,在急性血栓模型中,血小板膜凍融復合物微泡能夠有效靶向急性血栓,因此有效低提高急性血栓診斷的超聲信噪比。如圖16所示,在慢性血栓模型中,血小板膜凍融復合物微泡在慢性血栓處無富集,其超聲信噪比沒有顯著變化。通過對急性血栓以及慢性血栓進行蘇木精-伊紅以及馬松染色分析證明二者組分有明顯差異,在急性血栓中以纖維蛋白為主而在慢性血栓中以膠原為主,血小板膜凍融復合物微泡在二者診斷中的平均超聲信噪比有顯著性差異。
綜上所述,本發明采用反復液氮冷凍-室溫融化的方式向血小板膜中摻雜磷脂并得到血小板膜凍融復合物囊泡。通過Langmuir-Blodgett膜天平測試得到凍融復合物中的磷脂蛋白質分子在氣液界面的表面張力顯著降低,通過差適量熱掃描技術測試表明摻雜后的血小板膜玻璃態轉變溫度降低。利用超聲輔助的方式向血小板膜凍融復合物囊泡中鼓入六氟化硫氣體,在氣液界面形成血小板膜凍融復合物微泡。通過熒光標記的方式定位血小板膜蛋白,并成功示蹤其融合在血小板膜凍融復合物微泡。通過對血小板膜凍融復合物囊泡以及血小板膜凍融復合物微泡進行蛋白質組學分析,發現血小板膜凍融復合物微泡繼承了血小板膜凍融復合物囊泡61.4%的蛋白質種類,并維持了血小板膜表面的整合素αIIβ3活化的構象。在大鼠下腔靜脈急慢性血栓模型實驗中,血小板膜凍融復合物微泡能夠特異性識別急性血栓,其對于急性血栓診斷平均信噪比為12.47 dB,而慢性血栓為0.1dB。










