合作客戶/
拜耳公司 |
同濟大學 |
聯合大學 |
美國保潔 |
美國強生 |
瑞士羅氏 |
相關新聞Info
人胰島素的朗繆爾單分子層膜的表面化學和光譜學性質——結果和討論
來源:上海謂載 瀏覽 1146 次 發布時間:2021-11-29
3. 結果和討論
3.1. 表面壓力和表面電位面積等溫線。 表面壓力和表面電位 ? HI-Langmuir單層的面積等溫線如圖1所示。 表面壓力和表面電勢的提升對應于750和900?2分子 ? 分別為1。 與表面壓力相比,人們期望在更大的表面電勢區域觀察到升力。 這是由于表面偶極子的長程相互作用,而范德華相互作用主要由表面壓力測量。 關于極限分子面積,即表面壓力線性部分的外推 ? 零表面壓力的面積等溫線,值為620?2分子 ? 獲得1。 該區域對應于空氣中HI蛋白的最緊密狀態 ? 水界面,該值與先前發表的關于牛胰島素Langmuir單層的研究一致。3,17
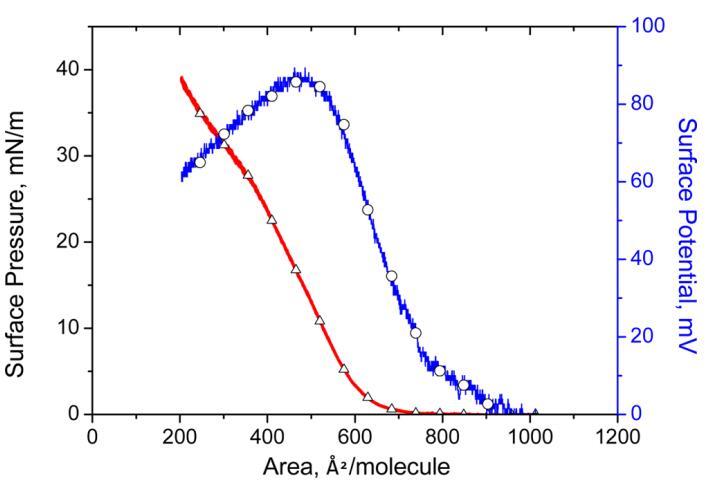
圖1。 表面壓力( △) 表面電位 ? 區域( ○) 亞相pH值5.6時人胰島素Langmuir單層的等溫線。
將分子面積從750減小,可以觀察到表面壓力下的氣-液膨脹相變 ? 面積等溫線。從585進一步降低到350表明朗繆爾單層的液體冷凝相。一個達到坍塌表面壓力25.2mN m ? 1.坍塌前的表面壓力測量顯示π線性增加 ? 等溫線。穩定性測量的下一節將顯示HI-Langmuir單層在二維中是穩定的。
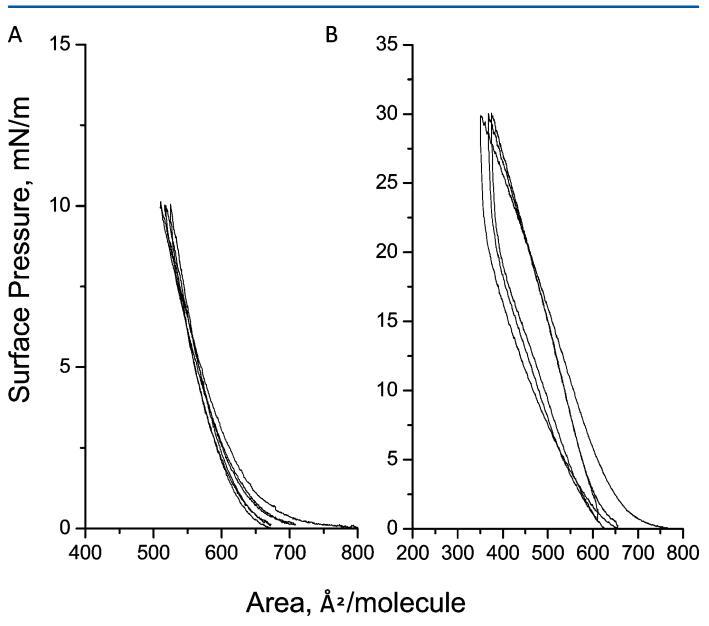
圖2.三個壓縮 ? 在亞相pH值5.6下,減壓循環達到10(a)和30 mN/m(B)的人胰島素Langmuir單層表面壓力。
3.2.壓縮 ? 人胰島素Langmuir單層的減壓周期和穩定性等溫線。圖2A和B顯示了壓縮 ? 在兩個目標表面壓力(即10和30 mN m)下測得的減壓循環等溫線 ? 1.選擇這兩種表面壓力的基本原理是觀察液體冷凝膜中膜在坍塌表面壓力前后的穩定性。壓縮后 ? 從0到10和30 mN m的減壓循環 ? 1,我們觀察到初始壓縮和最后減壓(第三個循環)之間的變化分別小于5%和10%。這一結果表明HI蛋白仍保留在界面上。必須指出的是,高達10 mN m的循環 ? 1顯示了等溫線的重疊,這支持了胰島素蛋白可能在液體膨脹和濃縮階段保持其構象的解釋。關于HI-Langmuir單層的穩定性(圖3),觀察到當單層在10和30 mN m保持恒定時,面積隨時間減少 ? 1在6500年代期間。測量到10和30 mN m的下降15%和60% ? 1。崩塌后,崩塌表面壓力預計會大幅降低。通過BAM研究HI聚集的可能性,并將HI與FITC結合,稍后將討論。
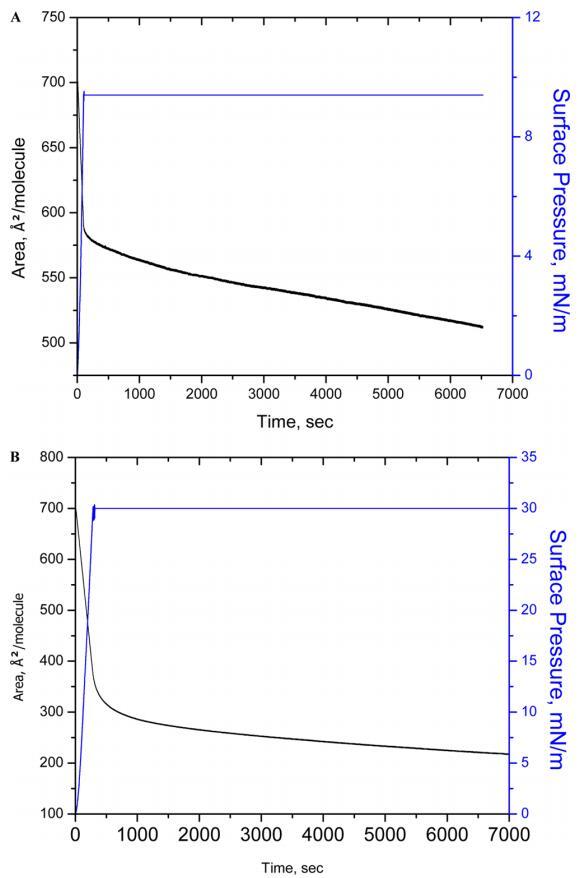
圖3.在亞相pH值5.6下,在表面壓力為10(A)和30 mN/m(B)的條件下,對人胰島素Langmuir單層膜進行90 min的穩定性測量。
3.3.紫外線 ? 人胰島素在水相和Langmuir單層膜中的可見光譜和熒光光譜研究了HI在水溶液(pH 2)中的光物理性質 和作為Langmuir單層,分別如圖4和圖5所示。圖4包括溶液中人胰島素的吸收光譜和發射光譜。水HI(pH 2)的發射峰 當在270 nm處激發時,在305 nm處觀察到。該峰對應于HI中存在的四種酪氨酸氨基酸。該值與在pH值為7(即303)的其他工作中獲得的值相當 ? 然而,在空氣中為305 nm.21 ? 水界面,在270 nm激發時未觀察到熒光(圖5B)。觀察到的唯一峰是294 nm處的拉曼峰。這可以解釋為HI濃度低(0.3 mg/mL) 這是生成表面壓力等溫線所必需的。因此,由于HI作為Langmuir單層沒有熒光,因此無法在作為Langmuir單層的HI和溶液中的熒光光譜之間進行關聯或比較。
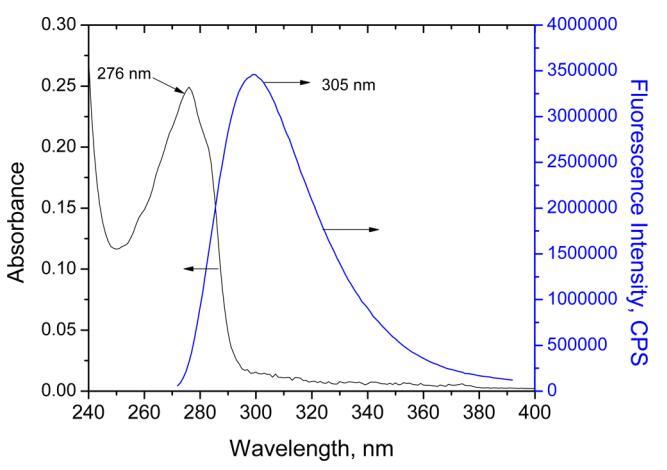
圖4.紫外線 ? vis(5×10 ? 5米)和熒光(5×10 ? 7 M;λ激發=270 nm,激發和發射處的狹縫寬度,分別為5和5 nm)人胰島素水溶液的光譜。
通常蛋白質中的芳香族氨基酸在260左右出現峰值 ? 280 nm,220附近有一個峰,這是由于肽鍵引起的。 圖5A所示的光譜在紫外光譜中呈現出276 nm處的峰值 ? 由于蛋白質中存在酪氨酸而產生的可見光譜。 除了276nm處的峰外,由于肽鍵的作用,蛋白質預計在190nm處有一個強峰,在210和220nm之間有一個弱峰。 在溶液中,觀察到的人胰島素的唯一峰值為276nm。 溶液中不同濃度的人胰島素產生的光譜寬肩接近200 ? 220 nm,表明肽鍵引起的峰重疊。 圖5A顯示了人胰島素Langmuir單層的吸光度光譜。 在空中 ? 在水界面,在224和276nm處觀察到兩個不同的峰,代表人胰島素中存在的肽鍵和酪氨酸。 當這兩個峰值與增加的表面壓力對應時,它們呈線性關系。 空氣中吸光度的線性 ? 水界面表明HI單層在崩塌點之前的穩定性。
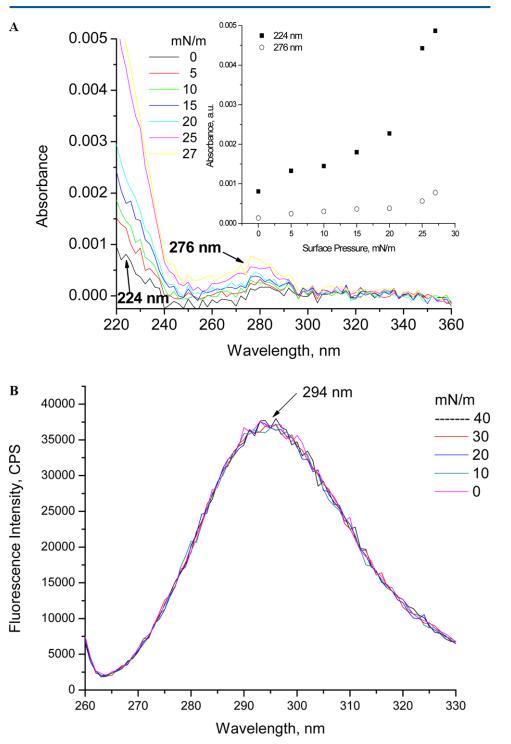
圖5.(A) 紫外線 ? 亞相pH值為5.6時人胰島素Langmuir的可見光譜。 插圖顯示了224和276 nm處吸光度隨表面壓力的變化。 (B) 亞相pH 5.6下人胰島素朗繆爾的熒光光譜(λ激發=270 nm,激發和發射時的狹縫寬度分別為5和5 nm)。
下一節將研究HI-Langmuir單層在二維域中潛在形成的地形。該觀察使用了兩種方法,即熒光法和布魯斯特角顯微鏡。22,23
3.4. 人胰島素朗繆爾單層的表觀熒光和布魯斯特角顯微鏡觀察。 人胰島素Langmuir單層的形貌通過FITC人胰島素的表觀熒光進行檢查,而布魯斯特角顯微鏡用于2-D純人胰島素。由于胰島素是非熒光的,因此必須附加熒光團才能使用表觀熒光顯微鏡。 蛋白質常用的探針是異硫氰酸熒光素(FITC)。
已知FITC胰島素的比例(1:1),計算分子量,以制備在空氣中攤鋪的適當濃度的水溶液 ? 水界面。 在5、10、20和30 mN m的表面壓力下獲得了表面熒光顯微照片 ? 1,如表1所示。 在所有表面壓力下均觀察到均勻的HI-Langmuir單層,圖像中未顯示μm范圍內的疇的形成。 為了驗證這一觀察結果,采用布魯斯特角顯微鏡(BAM)在與表觀熒光顯微鏡相同的壓力下對薄膜的形貌進行成像。 BAM數據證實了表觀熒光測量結果。 為了確保BAM系統正常工作,對花生酸Langmuir單層進行了檢查。 觀察到的地形證實了已經公布的結果(表1)
表1。 通過(A)HI-FITC-Langmuir單層樣品的表觀熒光測量了四種表面壓力; (B) BAM用于胰島素HI-Langmuir單層; (C) 花生酸Langmuir單層BAM(胰島素濃度:0.30 mg/mL)

3.5. 胰島素的二級結構。 為了研究胰島素分子在2-D中相互作用的性質,通過紅外光譜檢查HI水相和Langmuir單層。 研究了HI水相的FTIR和圓二色譜(CD),而HI-Langmuir單層膜采用紅外反射吸收光譜(IRRAS)。
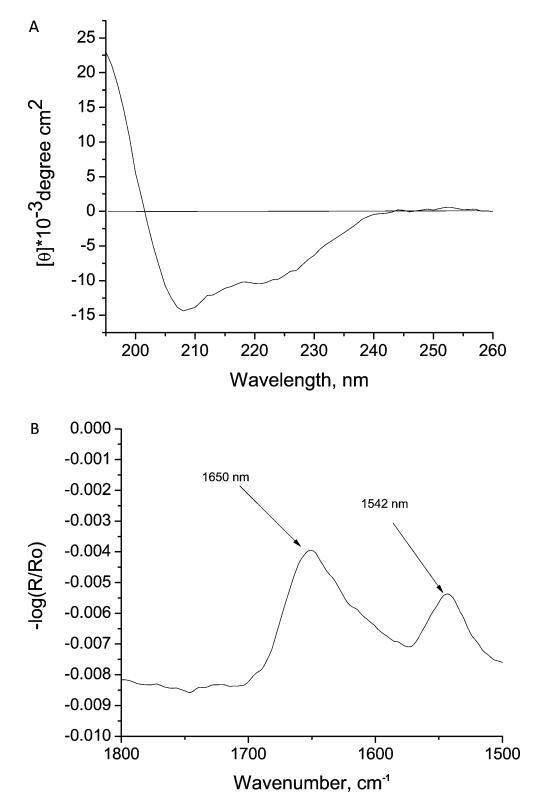
圖6。 (A) 在pH 2和溫度20±1°C條件下,水性胰島素的圓二色光譜和(B)FTIR光譜。胰島素濃度分別為0.3和2 mg-mL ? 分別為1。
如圖6A所示,與β-片相比,CD光譜包含高比例的α-螺旋。 它表明水相中存在單體且不存在聚集體。24圖6B顯示了水相HI的FTIR光譜,主峰位于1650、1542、1440和1373 cm處 ? 1. 1650和1542厘米處的峰值 ? 1對應于α-螺旋的酰胺I和酰胺II區域。25 ? 27 CD和FTIR光譜證實水性HI以α-螺旋存在,因此在水相中以單體形式存在。
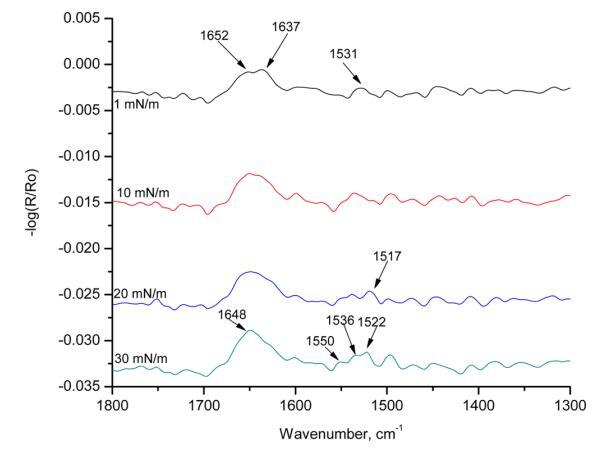
圖7。 在亞相pH 5.6條件下,使用60°入射角和改變表面壓力,對人胰島素Langmuir單層膜進行p極化輻照。
IRRAS是研究Langmuir單分子膜在空氣中取向和構象變化的重要技術 ? 水界面。 IRRAS測量值作為反射率獲得 ? 吸光度(RA)與波數。 RA定義為 ? log10(R/RF),其中R是薄膜覆蓋表面的反射率,RF是水的反射率。28 ? 30當振動與空氣平行時 ? 水界面,對于平行于入射面的p極化輻射,譜帶最初為負值,其強度隨著入射角的增加而增加,直到布魯斯特角(2920 cm為54.5°) ? 30通過在不同表面壓力下使用IRRAS,我們研究了HI-Langmuir單層膜的取向和構象的變化(圖7、8和9)。 IRRAS用于分析蛋白質的結構特征,例如通過1700區域的酰胺I和酰胺II帶解釋的α-螺旋和β-折疊 ? 1600和1600 ? 1500厘米 ? 分別為1.19,20
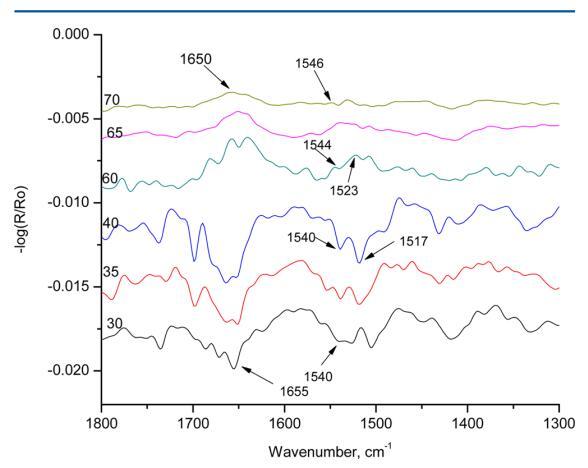
圖8。 在亞相pH值5.6和表面壓力10 mN/m以及改變入射角的條件下,人胰島素Langmuir單層膜的p極化輻照。
給出了三種IRRAS光譜。 圖7顯示了不同表面壓力下60°的極化,圖8顯示了10 mN/m的恒定表面壓力和30到70°范圍內的變化角度,圖9顯示了25°恒定角度和變化表面壓力下的s極化。 表2給出了α-螺旋和β-片的譜帶特征以及對應于α-螺旋的酰胺I和酰胺II振動。
圖7顯示了HI-Langmuir單層在不同表面壓力下60°時的p極化。 這條帶子在1517厘米處 ? 1對應于α-螺旋。 在1 mN/m的表面壓力下,有兩個可見帶:1652和1637 cm ? 1. 隨著表面壓力的增加,這兩個譜帶重疊并成為一個寬帶。 在30百萬米 ? 1,波段可視為單個波段,頻率為1648厘米 ? 1. 這是對應于α-螺旋的酰胺II區域的條帶。 下一個波段在1531厘米處以1 mN/m的寬帶出現 ? 1. 隨著表面壓力的增加,它分成三個帶:1550、1536和1522厘米 ? 1. 在1550和1522厘米處的頻帶 ? 1分別對應于α-螺旋和β-折疊中的酰胺II區域。 這種譜帶分裂表明,譜帶位于1531厘米處 ? 在較低的表面壓力下,1由α-螺旋和β-片組成。 在較高的表面壓力下,譜帶分離為離散的單個峰。 光譜中出現的其他峰是由于氨基酸和烷烴鏈的存在。 這條帶子長1448厘米 ? 1對應于C ? H CH2和CH3的剪切。 HI-Langmuir單分子膜的p-極化輻照度中存在所有三個表明α-螺旋的主譜帶。
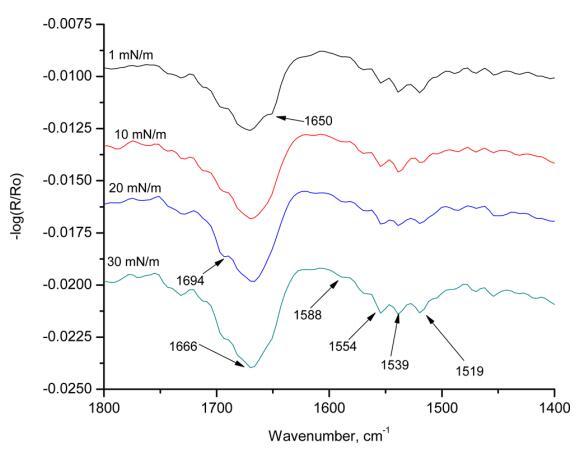
圖9。 亞相pH為5.6,入射角為25°,且改變表面壓力時,人胰島素Langmuir單層的s極化輻照。
圖8顯示了HI-Langmuir單層在10 mN m處的p極化 ? 1在30、35、40、60、65和70°的六個不同角度。 在布儒斯特角之前,30、35和40 mN/m處的角未顯示出β片的特征帶。 所有三個角度顯示1655和1540厘米處的條紋 ? 1分別對應于酰胺I和酰胺II吸收。 這條帶子在1517厘米處 ? 1,對應于α-螺旋,在35°和40°中存在。 在布儒斯特角之后,所有60、65和70°的三個角都顯示出介于1650和1655之間的帶,這對應于α-螺旋中的酰胺I吸收。 當角度為60°時,在1523 cm處可以看到峰值 ? 1,對應于β片。 光譜中的其他譜帶都不是α-螺旋或β-片的特征。 光譜表明HI在空氣中以α-螺旋的形式存在 ? 水界面。 在10 mN m的恒定壓力下,隨著角度的增加 ? 1,發現光譜中的α-螺旋特征減少。
圖9顯示了在不同表面壓力下獲得的HI-Langmuir單層膜的s偏振輻照度。 在1 mN m的表面壓力下 ? 1,在1650 cm處存在一條帶 ? 1對應于α-螺旋。 隨著表面壓力的增加,該條帶消失,并在1666 cm處并入該條帶 ? 1. 這條帶子長1666厘米 ? 1包括β-轉角和α-螺旋。 這條帶子有1694厘米長 ? 1對應于β片。 這條帶子在1519厘米處 ? 1也對應于α-螺旋。 在入射角為60°的情況下,在1670處觀察到的能帶可歸屬于存在于β-轉角中的空間約束C=O部分,或者由于β-薄片中的躍遷偶極耦合而注意到峰值中的分裂。 當改變表面壓力時,最強烈的譜帶出現在1554和1539厘米處 ? 1,兩條帶均對應于酰胺II區的α-螺旋。 所有三條主譜帶都表明HI-Langmuir單層的s極化輻照度中存在α-螺旋。
表2。 α螺旋和β片的主帶位置特征及酰胺Ⅰ和酰胺Ⅱ的紅外振動

從上述CD、FTIR和IRRAS數據可以得出結論,溶解在pH 2中的HI在溶液和空氣中以螺旋構象存在 ?
人胰島素的朗繆爾單分子層膜的表面化學和光譜學性質——摘要、介紹
人胰島素的朗繆爾單分子層膜的表面化學和光譜學性質——實驗部分
人胰島素的朗繆爾單分子層膜的表面化學和光譜學性質——結果和討論
人胰島素的朗繆爾單分子層膜的表面化學和光譜學性質——結論、致謝!










