合作客戶/
拜耳公司 |
同濟大學 |
聯合大學 |
美國保潔 |
美國強生 |
瑞士羅氏 |
相關新聞Info
蛋白質外聚物中多糖的比例——方法
來源:上海謂載 瀏覽 959 次 發布時間:2021-10-12
二、方法
2.1. 中宇宙的實驗方法
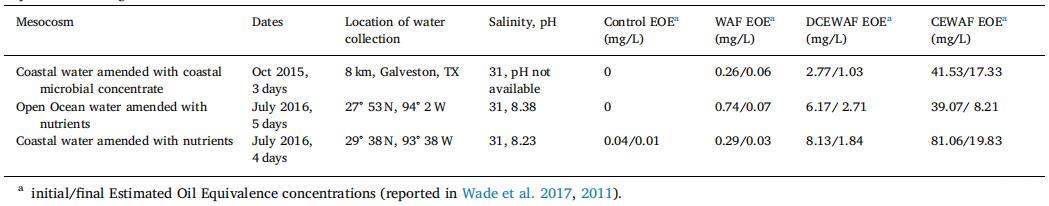
海水是從墨西哥灣收集的,用于填充 12 罐,每個 130 L,其中 4 個處理一式三份: 對照(海水)、WAF(用 Macondo 替代油,一種輕質低硫原油,化學性質類似于 在深水期間從 Macondo 井中溢出的石油 Horizon 事件)、CEWAF(Corexit + oil 比例為 1:20)和 DCEWAF (CEWAF 稀釋十倍)。 仔細描述了中間宇宙的設置 在韋德等人。 (2017) 以及準備 WAF 的程序, CEWAF 和 DCEWAF。 簡而言之,注入油或油 + Corexit 進入帶擋板的再循環罐并混合約 24 小時,然后將下層 分數(即,避免表面光滑)被添加到各自的 坦克。 有關中宇宙實驗的信息在表 1 中給出 根據估計值添加初始和最終油濃度 根據 Wade 等人確定的油當量 (EOE)。 (2011 年,2017 年)。 實驗持續 3 到 5 天,運行 12:12 明暗循環。 在表 1 中,對于使用沿海 用微生物濃縮物修正的水域,浮游生物(≥63 μm)是 用網收集并轉移到聚碳酸酯瓶中。 這個 將濃縮的浮游生物塊引入罐中并攪拌(2 L 到每個)在開始實驗之前。 對于公海水域和沿海水域的中宇宙,營養物質進行了修正, 添加營養物(最終濃度 f/20)并攪拌罐。
表格1 中觀的實驗設計。
本研究的樣品是從水柱中提取的 24 小時,根據 Xu 等人詳細介紹的方法進行分析。 (2018a,2018b)。 簡而言之,對于本研究,從水中提取的樣品等分試樣 通過 0.45 μm FlipMate 以 < 100 mmHg 的壓力輕輕過濾色譜柱 去除顆粒的裝置 (Environmental Express SC0301C)。 這 然后在 3 kDa 超速離心膜(Amicon Ultra-15,EMD # UFC900396)中處理 0.45 μm 濾液以收集膠體(3 kDa 截留物)級分。 收集 3 kDa 截留物并 用 18 MΩ -cm 沖洗 3 次,直到最終體積至少濃縮 25 倍。 這種 EPS 膠體部分來自水中 然后將 < 0.45 μm 和 > 3 kDa 的色譜柱用于本工作中提到的大多數測量。 測量每個EPS膠體樣品 對于蛋白質和多糖,如下所述,并用 3 kDa 超濾滲透液(真正溶解的部分;濾液) 3 kDa 超濾器)來自用于測量的對照處理 SFT 以保持原始中宇宙樣本的離子組成。
2.2. 化學品和實驗室器具準備
除非另有說明,所有化學品均來自 Sigma 并且是 97% 純 ACS 級或更高。 除非使用的水是天然海水,否則所有使用的水都是 18 MΩ –cm Milli-Q I 型水。 除非 指定,ASW(Millero 1996,第 67 頁),單個組件 MgCl2、NaCl 和 Na2SO4 在 450°C 下燃燒 4 小時。 所有實驗室用品 用自來水沖洗三次,在 1% 的溶液中浸泡 12 小時。 Micro-90® 肥皂溶液(VWR,目錄號 89210-140),用 18 MΩ –cm Milli-Q 水,在 3 M HCl 中浸泡 12 小時,并沖洗三次 18 MΩ –cm Milli-Q 水。 如果使用玻璃器皿,則另外 在 450 °C 下燃燒 4 h。
2.3. 標準生物大分子實驗
為了評估蛋白質和多糖(單獨 或組合)在 SFT 上,實驗是在人工 海水,ASW,使用牛血清白蛋白(BSA,來自 Pierce 蛋白 檢測試劑盒,ThermoFisher),其等電點 pI 為 4.7–5.4 (視情況而定)。 此外,為了代表多糖,我們 使用過存在于水中的葡萄糖醛酸(Sigma,CAS 6556-12-3) 墨西哥灣柱(Hung 等人,2003 年;Xu 等人,2011 年)。 它是一個 具有與 D-甘露糖醛酸相似物理化學性質的差向異構體和 L-古洛糖醛酸,海藻酸的主要成分和豐富的 細菌外聚合物、生物膜和褐藻的成分。 葡萄糖醛酸的 pKa 為 2.8-3.2(取決于分子構型)。 在 pH 值為 ~8 的 ASW 中,這些部分將被去質子化,這將增強它們的表面反應性。
2.4. 表面張力
SFT 使用 Kibron EZ Pi-Plus 張力計測量,該張力計 采用 Du Nouy-Paddy 技術結合 0.5 mm 直徑探針(Padday 等人,1975 年)。 探針是金屬合金的 一種親水性氧化物,與樣品的接觸可以忽略不計。 這 聚丙烯杯中的 1.5 mL 樣品使用循環水浴保持在 22.5 ± 0.3 °C 的恒溫。 探針是 通過用丁烷炬燃燒來清潔樣品之間。 每個 樣品至少測量四次,重復測量顯示 ≤ 5% 的相對標準偏差 (RSD)。 這 儀器針對 18.2 MΩ –cm 電阻率 I 型水進行校準。 疏水部分的濃度越高 EPS 膠體分數越低,表面張力越低。 因此,由于聚丙烯杯可能會吸附樣品中分子的更多疏水成分,因此實際的表面張力可能 低于表觀測量值,因此我們的測量值是 保守的。
2.5. 蛋白質和多糖測定
EPS 中的蛋白質含量是基于改良的二辛可寧酸方法(Smith 等人,1985 年)使用 Pierce 蛋白質測定的 檢測試劑盒(ThermoFisher),以 BSA 為標準。
使用蒽酮方法(Morris 1948)測定中性糖濃度,以葡萄糖為標準。 對于蒽酮試劑,0.05 g 蒽酮(CAS 90-44-8;終濃度 1 g/L 蒽酮)溶于 50 mL 濃硫酸中 玻璃燒杯,然后攪拌。 在每次應用此方法之前立即制備蒽酮試劑。 對于葡萄糖 標準儲備液,將 50 mg 葡萄糖(CAS 50-99-7;終濃度 1 g/L 葡萄糖)溶解在 50 mL 離心管中,然后填充 用 Milli-Q 水定容至 50 mL。 標準品的儲備溶液是 稀釋至最終體積 10 mL,例如,對于 5 mg/L 標準品 溶液,0.05 mL 儲備溶液,用 9.95 mL Milli-Q 水稀釋。 然后抽取各標準溶液 0.1 mL 和樣品 0.1 mL 放入單獨的 Pyrex 玻璃管中。 我們向每個管中添加了 0.2 mL 蒽酮試劑溶液并在 100°C 下加熱 10 分鐘。 之后 孵育,試管立即在冰浴中冷卻或 運行自來水,使它們迅速達到室溫。 這 在光電色度計中在 620 nm 處測量光密度。 該方法用于測定中性糖; 它不會 檢測帶電糖,如糖醛酸。
通過添加硼酸鈉 (75 mM) 來估計糖醛酸 濃硫酸和間羥基二苯,含葡萄糖醛酸 酸作為標準(Hung 和 Santschi 2001)。
蛋白質、中性糖和糖醛酸的濃度, 以 BSA、葡萄糖和葡萄糖醛酸當量表示,相對于溶解的有機碳(蛋白質 53%,40% 中性糖,糖醛酸 37%)。 然后蛋白質與多糖的比例計算為蛋白質/TCHO,其中TCHO(總 碳水化合物=中性糖+糖醛酸)。 因此,蛋白質:多糖的比例是(蛋白質 * 0.53)/[(中性糖 * 0.40)+(糖醛酸 酸 * 0.37),其中所有濃度均以 mg-OC/L 為單位(OC 是有機的 碳)。 EPS 組成和濃度計算公式為 從三個復制的中胚層罐中收集的樣品 每個處理(n = 3)。
2.6. 溶解有機碳測定
DOC 的濃度是在 Shimadzu TOC-L 分析儀上使用高溫燃燒法測量的(Xu 等人,2011 年;Guo 等。 1994)。 來自 0.7 um 預燃 Whatman GFF 的樣品濾液 用 2N HCl 溶液將膜酸化至 < pH 2,然后吹掃 用純空氣吹 10 分鐘以去除無機碳。 樣本是 然后在 680 °C 下燃燒并進行 CO2 測量以確定碳量。 為了計算 DOC 濃度, 減去系統空白并根據校準計算 曲線使用羥基鄰苯二甲酸鉀作為標準。 樣品 波動系數超過 3% 測量 3 次, 給出最低波動因子的兩個值的平均值是 采納。
2.7. 共聚焦激光掃描顯微鏡 (CLSM)
共聚焦激光掃描顯微鏡圖像是用 蔡司 LSM 880 共聚焦光譜顯微鏡成像系統,使用 Zstack 軟件。 所有樣品均使用人工海水制備 (ASW) 購自 Sigma(S9883 海鹽)并以 40 g/L 配制。 為了制備 WAF,將 200 μL Macondo 替代油緩慢加入到 在 500 mL 硼硅玻璃制成的瓶子中過濾 ASW 海水 帶有特氟龍襯里的帽子。 攪拌混合物并使其平衡24小時以制備WAF。 CEWAF 的制作方式相同,除了 在混合之前,Corexit 以 1:20 的 Corexit 與油的比例添加 與 ASW(Chiu 等人,2017 年;Wade 等人,2017 年)。 Corexit 治療 除了將 Corexit 添加到 ASW 組成 0.1% 的溶液。 溶液終濃度 BSA 和海藻酸 (Sigma, CAS 9005-38-3) 的濃度也為 0.1%。 這 將 500 mL 處理液倒置幾次,然后將 20 μL 等分試樣移液到載玻片上,與 100 mM 金霉素孵育 (CTC, Sigma CAS 64-72-2) 染料溶液在每次處理約 30分鐘。 如染料分布所示,分子擴散在小體積內快速。 圖像是在激發/發射 495 nm/519 nm 在 1 毫秒的時間內。
2.8. 掃描電子顯微鏡 (SEM)
SEM 樣品首先過濾到 0.03 um 聚碳酸酯上 跟蹤蝕刻膜過濾器(SPI Supplies, West Chester, PA, USA),然后 使用 4% 多聚甲醛固定,然后用磷酸鹽緩沖鹽水 (PBS) 洗滌,然后用去離子水沖洗(Tsai 等人,2017 年)。 使用 30%、50%、75%、95% 和 100% 的甲醇完成脫水(Tsai 等人,2017 年)。 使用 CO2 臨界點干燥器去除 任何殘留溶劑。 最后,在上面濺射鍍上一層薄薄的金 這些基材。 然后使用 FEI Quanta 200 獲取圖像 ESEM 系統(Tsai 等人,2017 年)。










