合作客戶/
拜耳公司 |
同濟大學 |
聯合大學 |
美國保潔 |
美國強生 |
瑞士羅氏 |
相關新聞Info
脂質納米粒與脂質體的結構差異及其形成機制
來源:百家號 藥物遞送 瀏覽 1446 次 發布時間:2022-09-13
脂質納米粒(Lipid Nanoparticle,LNP)是一種將核酸物質遞送至細胞的納米載體,由可離子化陽離子脂質、中性輔助磷脂、膽固醇、PEG脂質組成。制備過程采用乙醇注入法,將脂質乙醇溶液與核酸物質的酸性(pH=4)水性緩沖液迅速混合,在酸性條件帶正電的可電離脂質與帶負電的核酸物質靜電絡合形成納米粒;再以pH=7.4(高于陽離子脂質的pKa)的水性緩沖液對納米粒進行透析洗濾,形成完整的脂質納米粒-核酸遞送系統。
文丨塔卡拉瑪干的白楊
一、mRNA-LNP的結
關于mRNA-LNP的結構示意圖,在認識上存在一定的差異,不同的期刊有不同的結構示意圖,甚至同一期刊還有不同的結構示意圖。
首先在是Nature系列期刊中,就存在兩種明顯不同的示意圖,有的mRNA-LNP示意圖是單層膜結構,而有的文章則描述為雙層膜結構。Vaccines和Science期刊中描述的mRNA-LNP示意圖則類似于脂質體結構,為雙分子層結構。Biotechnology Advances和Journal of Controlled Release期刊則選用了單層膜的mRNA-LNP示意圖。
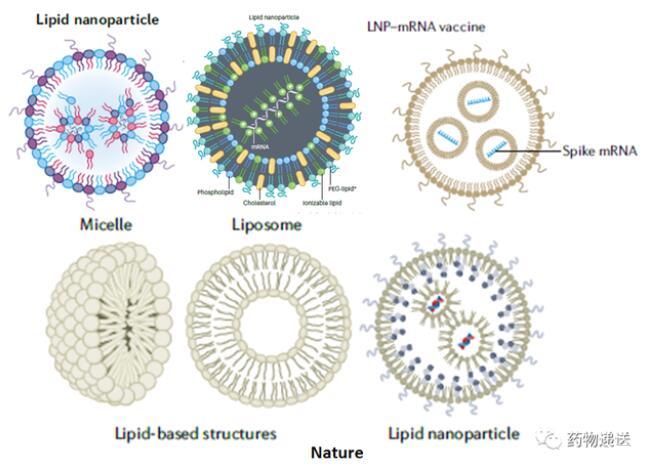
圖1 Nature系列期刊的mRNA-LNP結構示意圖
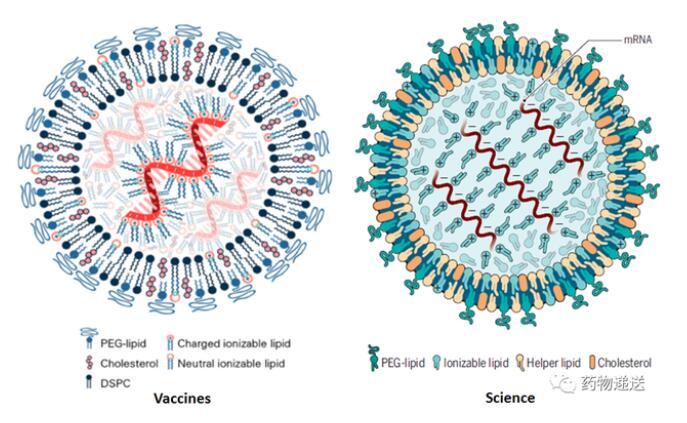
圖2 Vaccines和Science期刊的mRNA-LNP結構示意圖
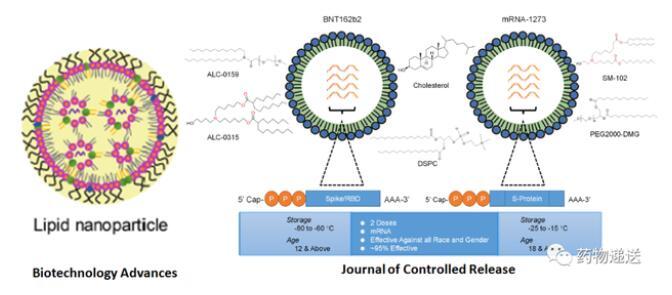
圖3 Biotechnology Advances和Journal of Controlled Release期刊的mRNA-LNP結構示意圖
Moderna公司描述的mRNA-LNP結構示意圖,以及International Journal of Pharmaceutics和Advanced Drug Delivery Reviews期刊描述的mRNA-LNP結構示意圖則更為抽象,尤其是International Journal of Pharmaceutics期刊,描述了三種不同的結構。
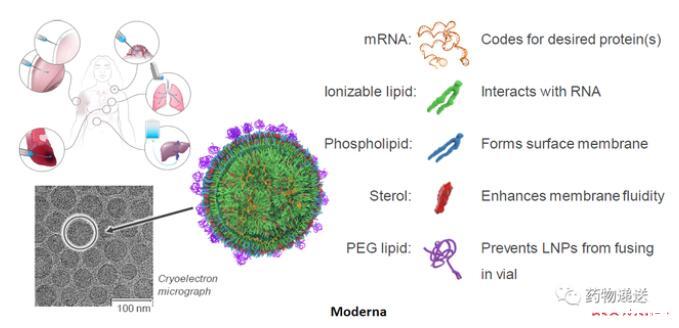
圖4 Moderna公司的mRNA-LNP結構示意圖
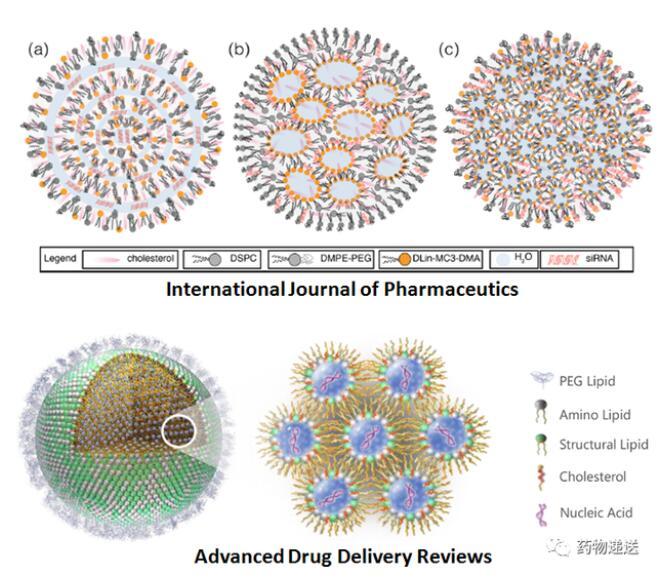
圖5 International Journal of Pharmaceutics和Advanced Drug Delivery Reviews期刊的mRNA-LNP結構示意圖
筆者認為,mRNA-LNP的脂質膜到底為單層結構還是為雙層結構,目前的顯像技術尚不能完全區分和識別,但對LNP技術進行溯源,可知其是在脂質體的基礎之上發展而來,LNP有包載遞送核酸物質的能力而脂質體卻不能有效遞送核酸物質,主要的區別在于LNP擁有實心內核,能更好地保護核酸物質不提前降解和釋放。此外,mRNA-LNP具有的內部核心,其實質是可電離的陽離子脂質與帶負電的核酸物質靜電作用絡合形成復合體,被包載于內部;倘若在不存在核酸物質的情況下,可能形成的就是脂質體,阿米卡星脂質體吸入混懸液便是利用制備LNP微流控技術來生產的。
二、siRNA-LNP的形成機制
關于帶電荷脂質和核酸物質包裹形成納米粒,用于胞內遞送的物理過程以及所形成的的結構,目前尚未有統一的認識。
以2018年8月10日FDA批準的Onpartro(Patisiran)為例,其作為首款采用LNP遞送siRNA的產品,是諾貝爾獎成果從概念走向臨床實際應用的里程碑。LNP-siRNA遞送系統是通過快速混合溶解脂質的乙醇溶液和pH=4.0的siRNA水性緩沖液,然后透析去除藥液中乙醇并調節pH=7.4,形成LNP-siRNA。通過低溫透射電鏡觀察到,LNP對核酸物質的包載效率接近100%,內部電子密度均勻。分子模型和實驗數據表明,LNP是具有包含核酸物質核心的納米結構。
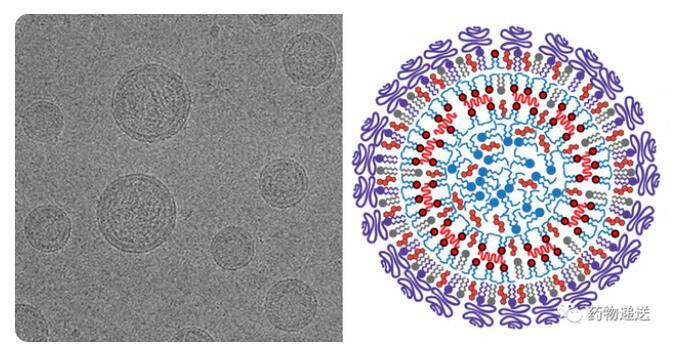
圖6 LNP的電鏡圖和結構示意圖
1、形成機制的研究
關于脂質納米粒的形成,曾經提出過一個“倒置膠束”(inverted micelles)假說,假說認為可電離的陽離子脂質先與核酸物質締合形成反膠束結構,過量的可電離脂質則形成“空”反膠束;反膠束和“空”反膠束締合形成疏水核,極性較大的脂質成分(如DSPC)再對疏水核進行包裹。然而,該假說并不能解釋脂質納米粒制備過程中的某些特征現象,例如脂質相和水相快速混合后的LNP-siRNA混懸液在pH=4.0時呈澄清透明,這表明此時脂質納米粒復合物的結構直徑小于30nm;以緩沖液透析置換后LNP-siRNA混懸液呈半透明,表明在此過程中形成了較大結構的脂質納米粒,也說明脂質納米粒的粒徑在該工藝過程中由小變大。
在此基礎上之上,不列顛哥倫比亞大學(Universityof British Columbia)教授彼得卡利斯(Pieter Cullis)對脂質納米粒的形成過程進行了深入的機制研究。Pieter Cullis教授在40多年前揭開了脂質納米粒應用的序幕,他的實驗室為脂質藥物遞送系統的發展做出了重要貢獻。
相關閱讀:詳解LNP作為藥物遞送技術的起源和專利糾紛
Pieter Cullis教授對Onpattro(首款上市的LNP產品)的處方進行了考察,Onpattro的處方為可電離脂質/DSPC/膽固醇/PEG化脂質= 50/10/38.5/1.5(mol/mol),N/P=3。冷凍電鏡結果顯示,在pH=4的水溶液中,形成的是粒徑較小的澄清透明的脂質納米混懸液;在緩沖液透析和置換的過程中,溶液的pH逐漸升高至7.4,受pH值的驅動,脂質納米粒在中性水溶液中逐步融合,形成粒徑較大的脂質納米粒,納米粒的中心形成多層堆疊的固體核心結構。初步估算平均每36個小粒子聚集成一個脂質納米粒。
此外還發現,采用乙醇稀釋/快速混合技術制備LNP-siRNA,當siRNA含量較高時,表現為堆疊的小雙層結構,其中siRNA被包載于緊密相連的脂質雙分子層之間;當siRNA含量較低時,堆疊結構的比例降低,LNP-siRNA復合物系統則表現出siRNA雙層結構和非晶態電子致密核的組合,這可能是由中性形式的可電離陽離子脂質產生的油滴而形成。所得結論為:含可電離陽離子脂質的LNP體系在pH=4時形成雙層結構,在pH=7.4時形成非晶態“固體核”結構。
2、影響LNP形成的因素
使用帶電荷脂質制備siRNA-LNP時,正電荷與負電荷的數量比會影響納米粒的大小、穩定性、電位等性能。在siRNA-LNP中,正電荷通常為具有可電離銨根(N)的陽離子脂質,而負電荷則為帶有大量磷酸根(P)的核酸分子,兩者可通過靜電吸附的方式結合在一起。因此,不合理的比例可能會導致粒徑過大、穩定性差等缺陷。值得一提的是,在研究中發現,當N/P=1時,pH中和后LNP的粒徑不會有較大改變;當N/P=3或者6時,LNP在pH=7.4的緩沖液中粒徑會變大。而永久陽離子脂質(例如DOTAP)制備的LNP在任何pH緩沖液中都不具有固體核心結構。
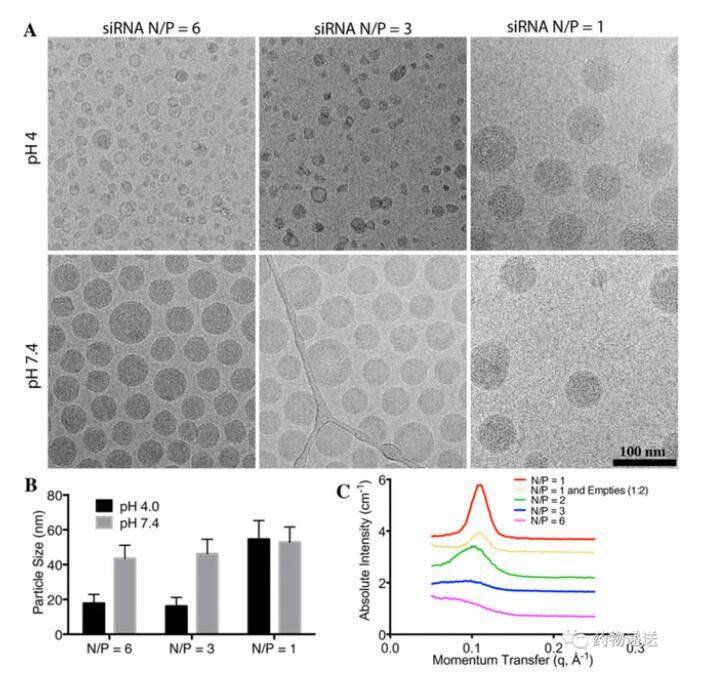
圖7 不同的N/P會影響LNP的粒徑
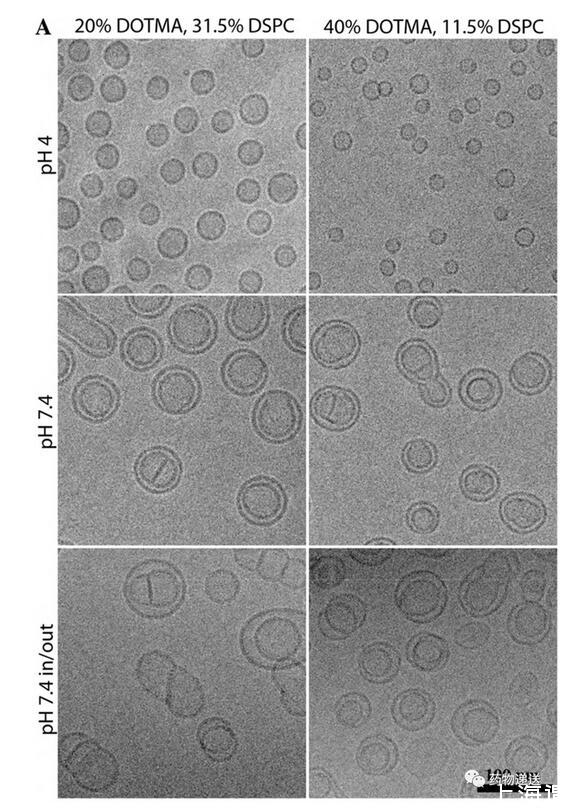
圖8 永久陽離子脂質制備的LNP無固態核心
同時研究了siRNA的存在對LNP的形成機制和結構的影響。在沒有siRNA存在的情況下,LNP脂質分散體在pH=4.0的條件下快速混合形成粒徑較小的單層小泡;隨著PBS緩沖液的透析pH值升高至7.4,較多的可電離陽離子脂質以中性形式存在,囊泡間的靜電排斥力降低,使得雙分子層結構穩定性變差囊泡間產生融合;當小囊泡融合時,PEG脂質、DSPC和膽固醇被分割到越來越大的LNP單外層,而中性的可電離陽離子脂質被分割到LNP的內部并在LNP中心形成油滴相;當外單分子層的PEG脂質濃度足夠高時,會抑制LNP之間的繼續融合,從而維持平衡態。值得注意的是,雖然平衡態粒徑的大小與PEG脂質的濃度有關,但其影響力比DSPC和膽固醇含量的影響要小得多。
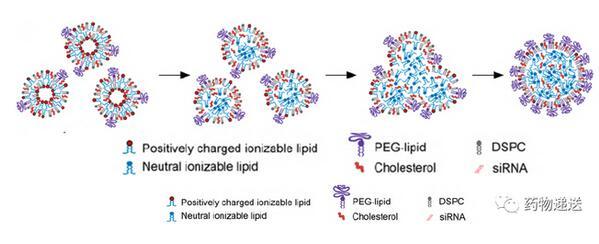
圖9 無siRNA情況下LNP的形成
在有siRNA存在的情況下,最初是在緊密相連的脂質單層之間形成包含siRNA的小囊泡;隨著pH值的升高,類似于不含siRNA的LNP,可電離脂質電位的中和會誘導脂質顆粒間的融合,這個過程受到復合物中PEG脂質、DSPC和膽固醇的相分離限制;有科學家提出,這些脂質沉積在表面單層,抑制脂質顆粒進一步融合。值得注意的是,高濃度乙醇(體積比不小于25%)會導致除單個脂質分子的高交換率(與siRNA復合的陽離子脂質除外),從而使得快速形成平衡結構;還需要指出的是,必須要有部分DSPC和膽固醇被分割在外單層,并且在pH=4時能維持更小結構的穩定,因為在含有1.5 mol % PEG脂質且沒有DSPC或膽固醇的體系中能觀察到非常大的微米級系統;隨著pH的升高,納米顆粒經歷的過程與不含siRNA時LNP的情況基本相同;可電離脂質向中性形式轉化的過程更利于增加在LNP內核中的融合和沉積。
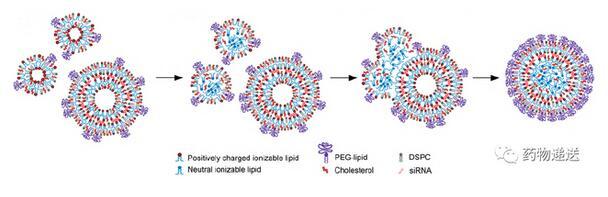
圖10 有siRNA情況下LNP的形成
3、結論
LNP-siRNA復合物是通過快速混合-乙醇稀釋過程形成,該復合物并沒有顯示出倒置的膠束結構,其中siRNA以“醋栗小圓面包”(currant bun)的形式分散在LNP內部。相反,siRNA與緊密貼合的脂質雙層膜相關,雙層脂質膜固定住siRNA分子,分離到LNP的外圍。過量的可電離陽離子脂質會形成一個無定形的脂質核心,類似于含有一定量膽固醇的油滴相。
這些研究表明,在優化的LNP-siRNA遞送系統中,不同種類脂類的比例可能會根據特定的可電離陽離子脂質而變化。例如,使用KC2脂質時,膽固醇在疏水核中的有限溶解度表明,應降低膽固醇含量以實現更穩定的體系。或者,增加DSPC的用量可能會增強較小的LNP給藥系統的穩定性和活性。此前已有研究表明,較小的LNP-siRNA給藥系統不如較大的給藥系統有效。
三、脂質體和脂質納米顆粒
脂質體和脂質納米粒的關鍵差異,不僅在于他們各自的應用不同,更主要在于他們自身的形態結構、組成和生產工藝存在差異。
從廣泛定義來講,脂質納米粒是以脂質形成的納米顆粒,這么劃分的話脂質體也是一種脂質納米粒。然而,在具體的科學研究中,脂質納米粒是用來描述一種不同于脂質體的特定類型納米粒。脂質體和脂質納米粒的最大區別在于形態,脂質體是脂質有序排列的雙分子層形成封閉囊泡,有親水的內部空腔結構;脂質納米粒則沒有親水空腔,相反,脂質納米粒因為陽離子磷脂和帶負電的核酸物質靜電絡合作用存在于內部,形成的多層核心分散于脂質層間。
在組成方面,主要成分大致相同,都含有脂質和膽固醇,只是脂質納米粒所用的脂質中必須要有可電離脂質,而脂質體對脂質的種類沒有嚴格要求。但在各成分的比例方面,脂質體和脂質納米粒存在較大差異,尤其是膽固醇的用量,以經典的脂質體產品DOXIL為例,HSPC:CHOL:DSPE-PEG2000=3:1:1;而已上市兩款mRNA新冠疫苗的組分中,膽固醇分別占比42.7%(Pfizer/BioNTech)和38.5%(Moderna),明顯高于脂質體中膽固醇的含量。
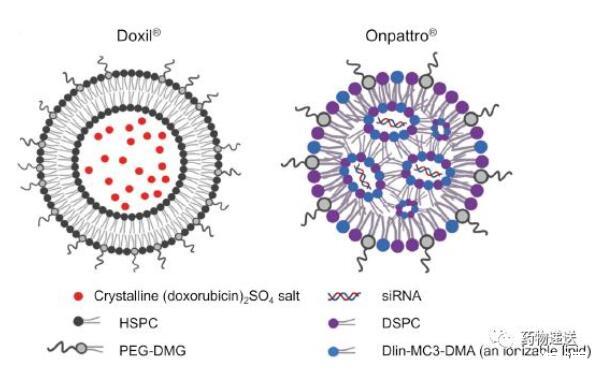
圖11 脂質體和脂質納米粒的差別
在生產工藝方面,脂質體和脂質納米粒在上游的工藝和步驟是不同的,但下游的生產過程幾乎一致。傳統的脂質體制備工藝,首先是脂質相和水相形成粗脂質體,再通過均質或擠出工藝將粒徑控制在一定的范圍內;而脂質納米粒是利用微流混合系統將脂質乙醇溶液和核酸酸性水溶液快速混合,微流混合系統的連接頭可以在兩相混合對撞過程中控制粒徑。脂質體和脂質納米粒下游的緩沖液置換工藝幾乎一樣,都是利用切向流動過濾(Tangential Flow Filtration,TFF)技術進行緩沖液的置換或純化,最后終端0.22μm濾膜過濾除菌。
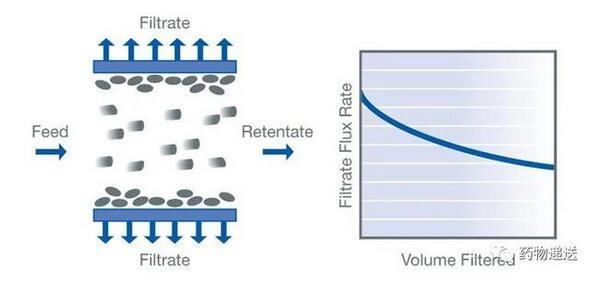
圖12 切向流動過濾技術示意圖
脂質體和脂質納米粒同宗同源,脂質體已在藥物遞送領域扮演重要角色,涉及到眾多適應癥,而脂質納米粒目前僅用于核酸物質的遞送,希望其在技術的積累和開發下得到廣泛應用。










