合作客戶/
拜耳公司 |
同濟大學 |
聯合大學 |
美國保潔 |
美國強生 |
瑞士羅氏 |
相關新聞Info
Delta-8 動物胃腸道體內中藥物的溶解度的測定——結果和討論
來源:上海謂載 瀏覽 1548 次 發布時間:2021-11-26
結果和討論
胃腸液的pH值和緩沖能力
表1總結了緩沖容量測定期間從解凍的胃腸液測量的胃腸液pH值。與之前的研究不同,這些pH測量值可能與原位GI pH測量值沒有直接關系。[6,12]圖1顯示了pH值變化為0.5和1.0單位時測得的緩沖容量的比較(ΔpH)。通常可以看出,在1.0 pH單位變化下測得的緩沖容量低于在0.5單位變化下測得的緩沖容量,這是由于與僅0.5 pH單位的變化相比,產生1.0單位pH變化所需的酸或堿比例更少,因為緩沖液在pH值進一步增加或降低超過其pka時會變弱。然而,在大鼠盲腸和結腸中,1.0單位pH變化時的緩沖容量高于0.5單位pH變化時的緩沖容量(圖1a);這可歸因于發酵產物中存在多種緩沖物質,例如具有不同pka值的短鏈脂肪酸。值得注意的是,豬的體液中沒有觀察到這種行為(圖1c),這可能是因為盲腸發酵在大鼠營養(糞噬)中比在豬中更重要。在兔液中也進行了類似的觀察(圖1b),平均而言,在0.5ΔpH單位下測得的緩沖容量高于在1.0ΔpH條件下測得的緩沖容量,但統計顯著性(P<0.05)僅見于空腸和盲腸。
表1大鼠、兔和豬胃腸液(上清液)的pH緩沖容量、滲透壓、表面張力以及美沙拉秦和潑尼松龍在這些液體中的溶解度。
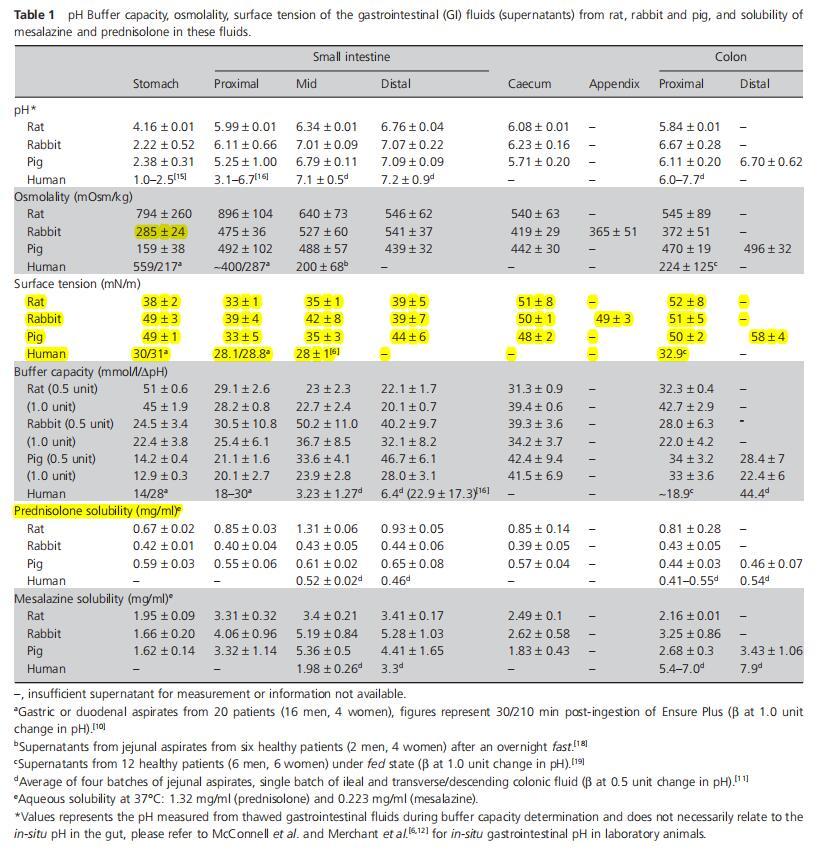
一般而言,豬和兔胃腸道的緩沖容量趨勢相似(圖1d)。胃的緩沖容量較低,然后小腸的緩沖容量增加(P<0.05),在中/遠端小腸達到峰值。在結腸中則下降(P<0.05)。然而,在大鼠身上可以看到相反的趨勢,胃液中的緩沖容量最高,小腸中的緩沖容量下降,盲腸和結腸中的緩沖容量再次增加。大鼠和豬的最高測量緩沖容量相似,但該峰值測量的GI位置不同,即胃(大鼠)和遠端小腸(豬)(圖1d)。
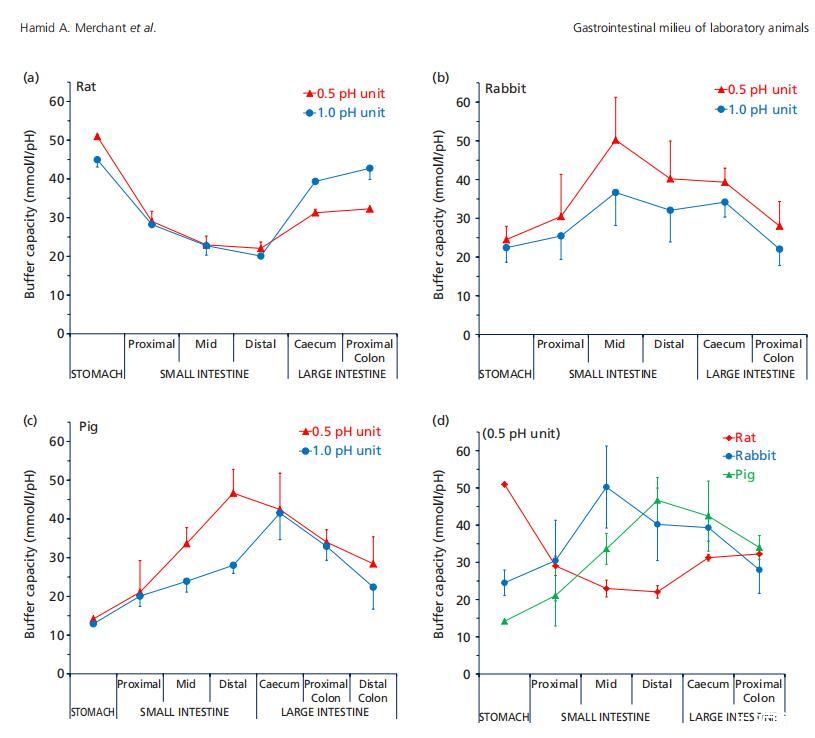
圖1(a)來自大鼠(n=3),(b)兔子(n=6),(c)豬(n=3)的混合樣品的胃腸液(上清液)緩沖容量(平均值±標準偏差(SD)),在pH單位變化0.5和1.0時測量,以及(d)整個胃腸道緩沖容量的種間趨勢。
通過比較這些動物物種和人類物種的緩沖能力趨勢,可以得出一些有趣的觀察結果。據報告,人胃吸出物的緩沖容量為14 mmol/l/ΔpH,在攝入液體餐后30分鐘(Sure Plus,Abbott Laboratories,Chicago,IL)增加到28 mmol/l/ΔpH,在攝入液體餐后210分鐘。[10]這也與膳食本身的緩沖容量有關(Sure Plus,24 mmol/l/ΔpH)。人類攝入液態膳食30分鐘后測得的緩沖容量與豬胃液中測得的緩沖容量相似,但令人驚訝的是,大鼠胃中的緩沖容量更高(表1)。在進食后30–210分鐘內,十二指腸吸出物的緩沖容量在18和30 mmol/l/ΔpH之間變化,與豬、大鼠和兔近端小腸的緩沖容量相似(分別為20.1、28.2和25.4 mmol/l/ΔpH)。然而,應該記住,Kalantzi及其同事測量了整個胃和十二指腸吸出物的緩沖容量,而我們的測量是在上清液中進行的。人類空腸和回腸液[11]的緩沖容量明顯低于大鼠、豬和兔子(表1)。
據報道,人類升結腸液上清液的緩沖容量約為18.9 mmol/l/ΔpH[19],顯著低于豬和大鼠近端結腸的緩沖容量(分別為33和42.7 mmol/l/ΔpH),但接近兔子的緩沖容量(22.0 mmol/l/ΔpH)。 然而,當測試來自人類的整個升結腸液而不是上清液時,估計緩沖容量要高得多(幾乎是兩倍)(37 mmol/l/ΔpH)。 作者認為,這是由于整個結腸液中普遍存在的細菌介導反應消耗了滴定酸。 [19]這也可歸因于結腸材料上的酸吸附,其在整個液體中占主導地位,而在上清液中占主導地位。 從人類遠端結腸樣本中測量的緩沖容量[11]幾乎是豬的兩倍(表1),而大鼠和兔遠端結腸中的緩沖容量無法測量,因為它們各自的遠端腸道中缺少液體。 然而,當測試來自人類的整個升結腸液而不是上清液時,估計緩沖容量要高得多(幾乎是兩倍)(37 mmol/l/ΔpH)。作者認為,這是由于整個結腸液中普遍存在的細菌介導反應消耗了滴定酸。[19]這也可歸因于結腸材料上的酸吸附,其在整個液體中占主導地位,而在上清液中占主導地位。從人類遠端結腸樣本中測量的緩沖容量[11]幾乎是豬的兩倍(表1),而大鼠和兔遠端結腸中的緩沖容量無法測量,因為它們各自的遠端腸道中缺少液體。
胃腸液滲透壓
三種動物模型的胃腸內容物的滲透壓通常遵循相同的趨勢,胃低,近端小腸增加,遠端減少。豬似乎沿著這種模式一直到盲腸,在結腸處進一步輕微增加(圖2)。然而,在大鼠中,由于胃滲透壓的高度可變性,胃內容物的滲透壓與近端和中端小腸的滲透壓沒有統計學差異。這種滲透壓模式通常與消化系統的生理學相一致,在消化系統中,大多數食物在小腸中被消化并分解為葡萄糖、氨基酸和脂肪酸等組成成分,因此液體的滲透壓較高。隨著營養被腸道進一步吸收,內容物的滲透壓降低。
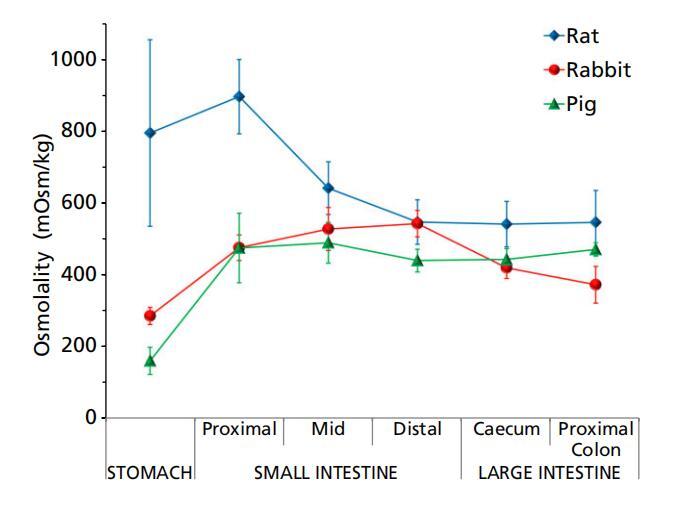
圖2大鼠(n=3)、兔子(n=6)和豬(n=3)胃腸液(上清液)的滲透壓(平均值±標準偏差(SD))。
在胃和近端小腸中,大鼠GI含量的滲透壓顯著高于兔子和豬(P<0.05)(圖2,表1)。當比較大鼠和豬的液體時,僅在近端腸道(胃、近端和小腸中部)發現統計意義,其中大鼠的滲透壓高于豬。家兔胃和遠端小腸(回腸)的滲透壓顯著高于豬(P<0.05),而胃腸道其他部位的液體沒有顯著差異。滲透壓的種間差異可能是由于這些動物的飲食不同、胃腸分泌物(酶、膽汁等)的種間差異或胃腸液中自由水與固體比率的差異。
當滲透壓數據與已發表文獻中的人體數據進行比較時,觀察到了有趣的趨勢。Kalantzi及其同事報告,在攝入液態膳食(Sure Plus)30分鐘后,人類胃液的滲透壓為559 mOsm/kg,高于喂養條件下兔子和豬胃液的滲透壓。然而,這與大鼠的胃滲透壓相似(表1)。研究還發現,研究前攝入的液體膳食的滲透壓(Sure Plus,610 mOsm/kg)對人體胃液的滲透壓有很大影響,因此,攝入30分鐘后,胃液的滲透壓(559 mOsm/kg)密切相關。進食210分鐘后,可能在胃排空后,這一水平降低到217 mOsm/kg。人十二指腸吸出物的滲透壓為~400mosm/kg,相對低于大鼠、兔和豬;然而,它與豬(492±102 mOsm/kg)和兔子(475±36 mOsm/kg)相當。還應注意的是,我們在動物身上的測量是在上清液上進行的,而Kalantzi等人使用的是整個胃和十二指腸抽吸物。禁食條件下人類空腸吸出物的滲透壓顯著低于喂養的大鼠、兔子和豬。[18]來自人類升結腸液的上清液[19]也顯示出顯著低于我們在大鼠、兔子和豬中測量的滲透壓(224 mOsm/kg)。
胃腸液表面張力
大鼠、兔和豬的胃腸液在整個腸道的表面張力明顯低于水的表面張力。這些動物的表面張力遵循一般模式,胃的表面張力較高,小腸的表面張力較低,而遠端腸道的表面張力再次升高(圖3,表1)。這種表面張力的行為也與腸道內的消化過程相一致。小腸環境中的消化營養物(如葡萄糖、氨基酸、脂肪酸)和消化分泌物(如膽汁)降低了該區域液體的表面張力,然后在遠端腸道中重新吸收,從而產生更高的表面張力。
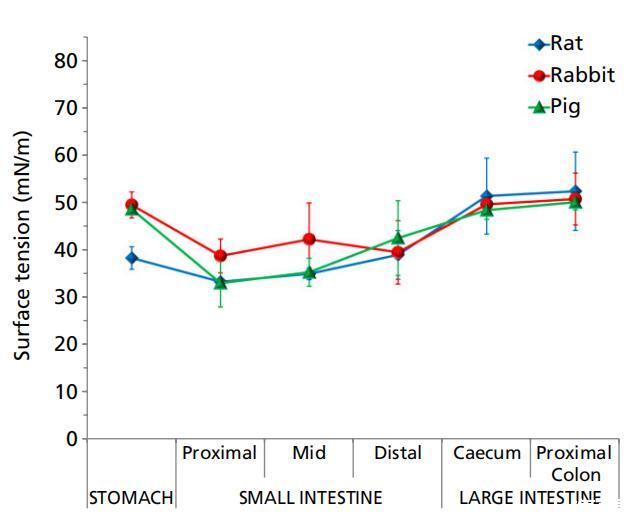
圖3大鼠(n=3)、兔子(n=6)和豬(n=3)胃腸液(上清液)的表面張力(平均值±標準偏差(SD))。 以水的表面張力為基準,測得其為72.8 mN/m。
大鼠胃內容物的表面張力與小腸的表面張力無統計學差異,但顯著低于盲腸和結腸(P<0.05)。 兔胃腸內容物的表面張力曲線具有特征性。 胃液的表面張力較高,近端小腸的表面張力較低(P<0.05),盲腸的表面張力顯著升高(P<0.05),結腸的表面張力保持不變。 豬胃液的表面張力比兔子高; 兔胃腸內容物的表面張力曲線具有特征性。胃液的表面張力較高,近端小腸的表面張力較低(P<0.05),盲腸的表面張力顯著升高(P<0.05),結腸的表面張力保持不變。豬胃液的表面張力比兔子高;然后在小腸中減少(P<0.05),在盲腸和近端結腸中增加以匹配胃水平,在遠端結腸中進一步增加(P<0.05)。
文獻中報道的人類胃腸道吸出物的表面張力低于我們在大鼠、兔子和豬身上的測量值。據報道,人胃吸出物的表面張力是~30 mN/m,在一段時間內相對恒定[10],低于大鼠、兔和豬胃液的表面張力,可按如下順序排列:人<大鼠<豬? 兔子類似的觀察結果也見于人十二指腸抽吸物,其表面張力最低(~28 mN/m)比動物物種(人類<大鼠? 豬<兔子)。如前幾節所述,值得注意的是,Kalantzi及其同事測試了整個胃和十二指腸抽吸物,而我們的測量是在動物胃腸液的上清液中進行的。與大鼠、兔和豬的近端結腸液的表面張力相比,人類升結腸液上清液的表面張力也最低(32.9 mN/m)[19]。
藥物在胃腸液中的溶解度
潑尼松龍的水溶性為0.223mg/ml;[11] 該值低于這些調查中觀察到的值(表1)。潑尼松龍的溶解度是合理恒定的,與豬和兔腸道樣本的位置無關,并且更接近于之前測量的人類空腸、回腸和結腸液體中的溶解度[11](圖4)。然而,從胃到小腸中部,潑尼松龍在大鼠體內的溶解度呈上升趨勢,此后,在遠端小腸中的溶解度下降,但在腸道下方沒有明顯變化。強的松在大鼠腸道液體中的溶解度通常高于人類,但在近端結腸除外,因為近端結腸的變異性更高,所以差異沒有達到統計學意義。與大鼠胃液相比,大鼠近端腸道的特殊溶解行為可能是由于近端和中段小腸的表面張力相對較低(表1)。由于潑尼松龍是一種可結合的化合物,其溶解度預計與pH無關;這與我們的研究結果是一致的。在任何受試動物物種中,潑尼松龍溶解度與緩沖容量、滲透壓或表面張力之間也沒有顯著關系(圖5)。
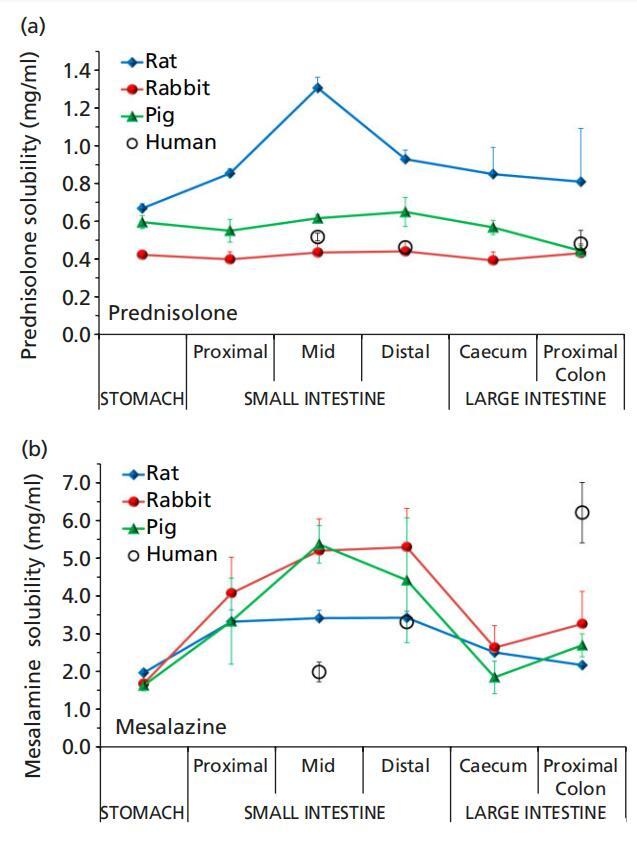
圖4(a)潑尼松龍和(b)美沙拉秦在大鼠(8只大鼠)、兔子(n=6)和豬(n=3)胃腸液(上清液)中的溶解度,Fadda等人的人類數據。[11]
美沙拉秦在兔和豬胃液、小腸液、盲腸液和近端結腸液中的溶解度相當。大鼠在胃中的溶解度與兔子和豬相當,但在小腸中段的溶解度顯著降低,這可能是由于豬和兔子的小腸中段的pH值和緩沖容量相對高于大鼠。報告的美沙拉秦在人體體液中的溶解度[11]僅與大鼠和豬在遠端小腸中的溶解度相當,而在人類空腸吸出物中的溶解度要低得多,在人類結腸液中的溶解度要比所有三種動物中的溶解度高得多(表1,圖5)。
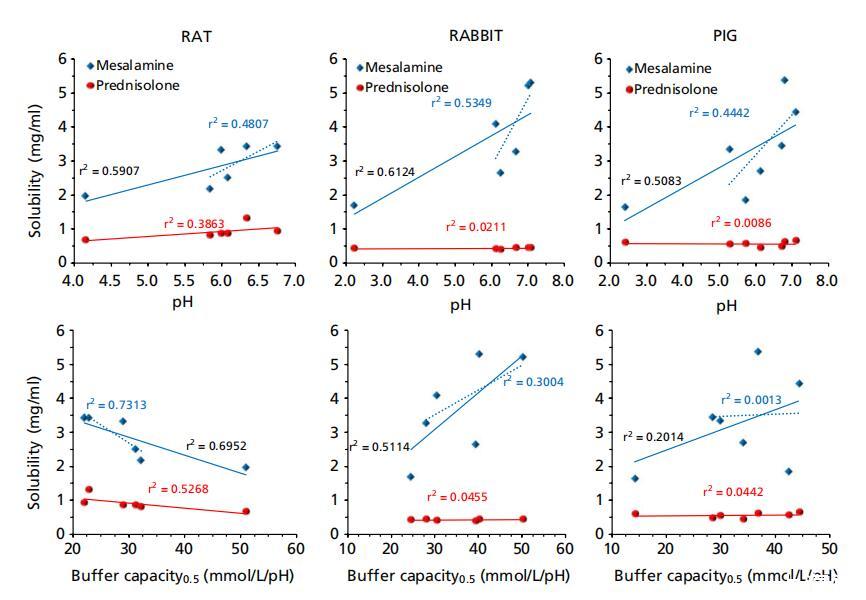
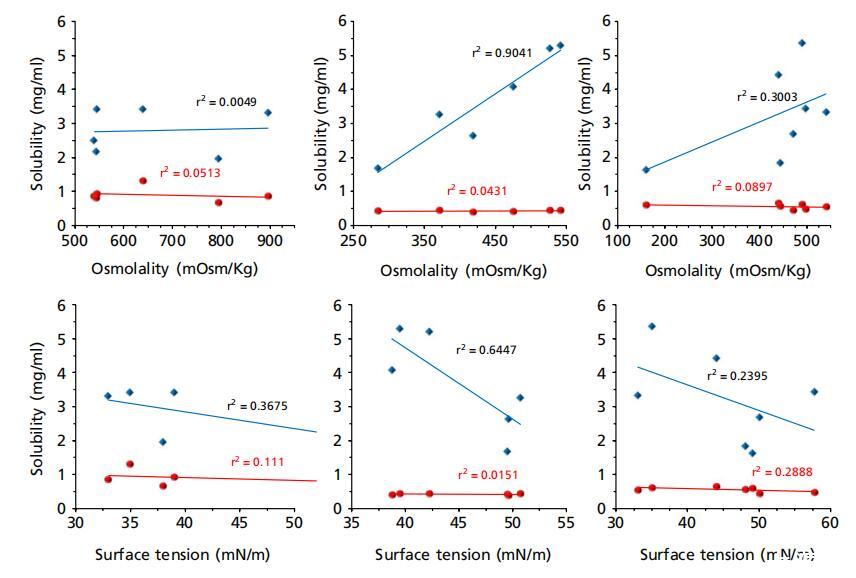
圖5:美沙拉秦(藍色鉆石)和潑尼松龍(紅色圓圈)在大鼠、兔和豬胃腸液(上清液)中的溶解度與其pH值、緩沖容量、滲透壓和表面張力的函數關系,其中藍色虛線表示除胃液外的美沙拉秦相關性。
當將美沙拉秦的溶解度作為pH值、緩沖容量、滲透壓和表面張力的函數進行研究時,發現美沙拉秦的溶解度與大鼠和豬的GI pH值呈正相關,這與人類的類似報告一致。[11]美沙拉秦是一種具有兩個可電離基團的兩性離子化合物, ? 酷和 ? NH2(pKa 2.3,5.99[17]),因此其在不同pH值的無緩沖水中的溶解度呈現U形曲線,通過添加等分的HCl或NaOH獲得,在極端酸性(pH<1)和堿性(pH>6)[17]下顯示峰值,對應于兩個可電離基團的pKa。 然而,在本研究中未發現這種U形行為,這可能是因為獲得的胃液最低pH值大于2.0(兔子和豬),而在大鼠中大于4.0。 還應了解,與French和Mauger使用的無緩沖水相比,胃腸液中存在多種緩沖物質。[17]然而,當通過省略胃腸液基本pH范圍內的胃腔(圖5中的虛線)來關聯pH數據時, 發現線性相關性表明,隨著腸道pH值的增加,溶解度增加,這與French和Mauger發現的行為一致。[17]然而,胃腸液中的溶解度程度低于報告[17],例如腸道液中的溶解度(pH ~ 7) 比在pH值下的無緩沖水中的報告值低三倍 ~ 6.5.
然而,對于清管器液體,與緩沖容量的相關性非常弱(對于ΔpH=0.5:標準化系數β=0.349,P=0.442;r2=0.201)。 但是,發現大鼠的體液具有非常強的相關性(ΔpH=0.5:標準化系數β),盡管呈負相關= 這可以通過大鼠胃液的緩沖容量顯著增加和大鼠胃液中緩沖容量的典型下降趨勢來解釋,表明pH值是可電離藥物美沙拉秦溶解度的相對更重要的驅動因素。 在兔子的胃腸液中,美沙拉秦溶解度與滲透壓(標準化系數β=0.951,P=0.004;r2=0.904)和pH(標準化系數β=0.783,P=0.066;r2=0.612)的相關性更強,而與緩沖容量無關 這與Fadda等人[11]的發現相反,后者報告了與緩沖容量的更強相關性。 但是,發現大鼠的體液具有非常強的相關性(ΔpH=0.5:標準化系數β),盡管呈負相關=?0.835,P=0.039;r2=0.695/對于ΔpH=1.0:標準化系數β=?0.997,P=0.001;r2=0.955)(圖5),與人體體液相反,[11]其中pH值和緩沖容量均呈正相關。這可以通過大鼠胃液的緩沖容量顯著增加和大鼠胃液中緩沖容量的典型下降趨勢來解釋,表明pH值是可電離藥物美沙拉秦溶解度的相對更重要的驅動因素。在兔子的胃腸液中,美沙拉秦溶解度與滲透壓(標準化系數β=0.951,P=0.004;r2=0.904)和pH(標準化系數β=0.783,P=0.066;r2=0.612)的相關性更強,而與緩沖容量無關(對于ΔpH=0.5:標準化系數β=0.716,P=0.109;r2=0.511/對于ΔpH=1.0:標準化系數β=0.571,P=0.236;r2=0.325)。這與Fadda等人[11]的發現相反,后者報告了與緩沖容量的更強相關性。
需要注意的是,Fadda等人[11]報告了使用體液的相關性 未考慮胃液中的溶解度,這在此處介紹的動物液中的相關性中得到了解釋。有趣的是,在排除動物液中的胃溶解度后,人和動物液中的相關性變得相似(圖5中的虛線) 此外,盡管區域pH值和緩沖容量較高,但豬遠端小腸的平均溶解度并不高于中小腸(表1),這可以通過該區域較高的表面張力(44±6 vs.35±3)來解釋 表面張力與美沙拉秦在兔子體內的溶解度之間存在一定的親和力(標準化系數β)= ? 0.802,P=0.055;r2=0.643)。需要注意的是,用于產生這些相關性的pH值對應于液體上清液中的測量值,這不一定與腸道中的原位pH值相關。
Delta-8 動物胃腸道體內中藥物的溶解度的測定——摘要、介紹
Delta-8 動物胃腸道體內中藥物的溶解度的測定——材料和方法










